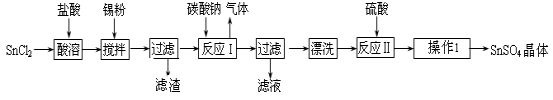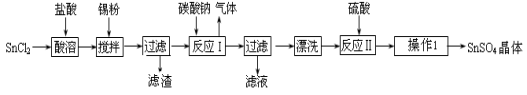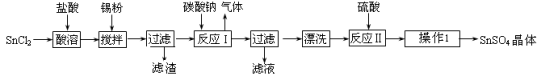-
【化工与技术--选作】硫酸亚锡(SnSO4)是一种重要的硫酸盐,广泛应用于镀锡 工业。某研究小组设计SnSO4制备路线如下:
工业。某研究小组设计SnSO4制备路线如下:
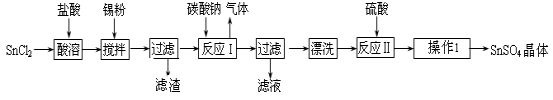
查阅资料:Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成碱式氯化亚锡, Sn相对原子质量为119。
回答下列问题:
(1)锡原子的核电荷数为50,与碳元素属于同一主族,锡元素在周期表中的位置是 。
 (2)操作Ⅰ是 。
(2)操作Ⅰ是 。
(3)SnCl2粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因 。
(4)加入Sn粉的作用有两 个:①调节溶液pH ② 。
个:①调节溶液pH ② 。
(5)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是 。
(6)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn + 2HCl=SnCl2 + H2↑;
②加入过量的FeCl3;
③用已知浓度的K2Cr2O7滴定生成的Fe2+,发生的反应为:6FeCl 2 + K2Cr2O7 + 14HCl =6FeCl3 + 2KCl + 2CrCl3 +7H2O。取1.226 g 锡粉,经上述各步反应后,共用去0.100 mol/L K2Cr2O7溶液32.0 ml。锡粉中锡的质量分数是 。
2 + K2Cr2O7 + 14HCl =6FeCl3 + 2KCl + 2CrCl3 +7H2O。取1.226 g 锡粉,经上述各步反应后,共用去0.100 mol/L K2Cr2O7溶液32.0 ml。锡粉中锡的质量分数是 。
-
(14分)硫酸亚锡(SnSO4)是一种重要的硫酸盐,广泛应用于镀锡工业。某研究小组设计SnSO4制备路线如下:
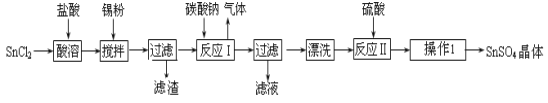
查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成碱式氯化亚锡, Sn相对原子质量为119
回答下列问题:
(1)锡原子的核电荷数为50,锡元素在周期表中的位置是 。
(2)操作Ⅰ是 。
(3)SnCl2粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因 。
(4)加入Sn粉的作用有两个:①调节溶液pH ② 。
(5)反应Ⅰ得到沉淀是SnO,得到该沉淀的离子反应方程式是 。
(6)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是 。
(7)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn + 2HCl===SnCl2 + H2↑;
②加入过量的FeCl3 ;
③用已知浓度的K2Cr2O7滴定生成的Fe2+,发生的反应为:
6FeCl2 + K2Cr2O7 + 14HCl ===6FeCl3 + 2KCl + 2CrCl3 +7H2O
取1.226 g 锡粉,经上述各步反应后,共用去0.100 mol/L K2Cr2O7溶液32.0ml。锡粉中锡的质量分数是 。
-
(13分)硫酸亚锡(SnSO4)是一种重要的硫酸盐,广泛应用于镀锡 工业。某研究小组设计SnSO4制备路线如下:
工业。某研究小组设计SnSO4制备路线如下:

查阅资料:Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成碱式氯化亚锡, Sn相对原子质量为119
回答下列问题:
(1)锡原子的核电荷数为50,与碳元素属于同一主族,锡元素在周期表中的位置是 。
 (2)操作Ⅰ是 。
(2)操作Ⅰ是 。
(3)SnCl2粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因 。
(4)加入Sn粉的作用有两个:①调节溶液pH ② 。
(5)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是 。
(6)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn + 2HCl=SnCl2 + H2↑;
②加入过量的FeCl3 ;
③用已知浓度的K2Cr2O7滴定生成的Fe2+,发生的反应为: 6FeCl 2 + K2Cr2O7 + 14HCl =6FeCl3 + 2KCl + 2CrCl3 +7H2O
2 + K2Cr2O7 + 14HCl =6FeCl3 + 2KCl + 2CrCl3 +7H2O
取1.226 g 锡粉,经上述各步反应后,共用去0.100 mol/L K2Cr2O7溶液32.0 ml。锡粉中锡的质量分数是 。
-
(14分)硫酸亚锡(SnSO4)是一种重要的硫酸盐,广泛应用于镀锡工业。某研究小组设计SnSO4制备路线如下:
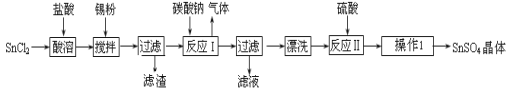
查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成碱式氯化亚锡,Sn相对原子质量为119
回答下列问题:
(1)锡原子的核电荷数为50,锡元素在周期表中的位置是 。
(2)操作Ⅰ是 。
(3)SnCl2粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因 。
(4)加入Sn粉的作用有两个:①调节溶液pH ② 。
(5)反应Ⅰ得到沉淀是SnO,得到该沉淀的离子反应方程式是 。
(6)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是 。
(7)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn + 2HCl===SnCl2 + H2↑;
②加入过量的FeCl3 ;
③用已知浓度的K2Cr2O7滴定生成的Fe2+,发生的反应为:
6FeCl2 + K2Cr2O7 + 14HCl ===6FeCl3 + 2KCl + 2CrCl3 +7H2O
取1.226 g 锡粉,经上述各步反应后,共用去0.100 mol/L K2Cr2O7溶液32.0ml。锡粉中锡的质量分数是 。
-
(10分)硫酸亚锡(SnSO4)是一种重要的硫酸盐,广泛应用于镀锡工业.某研究小组设计SnSO4制备路线如下:
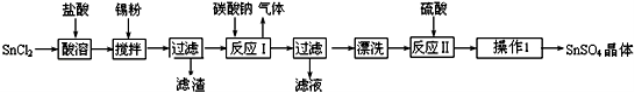
查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化.
Ⅱ.SnCl2易水解生成碱式氯化亚锡
回答下列问题:
(1)锡原子的核电荷数为50,与碳元素属于同一主族,锡元素在周期表中的位置是 .
(2)SnCl2粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因 .
(3)加入Sn粉的作用有两个:①调节溶液pH ② .
(4)反应Ⅰ得到沉淀是SnO,得到该沉淀的离子反应方程式是 .
(5)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是 .
-
硫酸亚锡(SnSO4)是一种重要的硫酸盐,广泛应用于镀锡工业。某研究小组设计SnSO4制备路线如下:
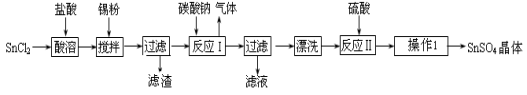
查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成碱式氯化亚锡, Sn相对原子质量为119
回答下列问题:
(1)锡原子的核电荷数为50,与碳元素属于同一主族,锡元素在周期表中的位置是 。
(2)操作Ⅰ是 过滤洗涤。
(3)SnCl2粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因 。
(4)加入Sn粉的作用有两个:①调节溶液pH ② 。
(5)反应Ⅰ得到沉淀是SnO,得到该沉淀的离子反应方程式是 。
(6)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是 。
(7)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn + 2HCl===SnCl2 + H2↑;
②加入过量的FeCl3 ;
③用已知浓度的K2Cr2O7滴定生成的Fe2+,发生的反应为:
6FeCl2 + K2Cr2O7 + 14HCl ===6FeCl3 + 2KCl + 2CrCl3 +7H2O
取1.226 g 锡粉,经上述各步反应后,共用去0.100 mol/L K2Cr2O7溶液32.0ml。锡粉中锡的纯度是 。
-
硫酸亚锡(SnSO4)是一种重要的硫酸盐,广泛应用于镀锡工业。某研究小组设计SnSO4制备路线如下:

查阅资料:Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成碱式氯化亚锡。(Sn: 119)
回答下列问题:
(1) 操作Ⅰ是________、过滤洗涤。
(2)SnCl2粉末需加浓盐酸进行溶解,目的是_______________________________。
(3)加入Sn粉的作用有两个:①调节溶液pH,②____________________________。[
(4)反应Ⅰ得到沉淀是SnO,得到该沉淀的离子反应方程式是___________________。
(5)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn + 2HCl SnCl2 + H2↑;
SnCl2 + H2↑;
②加入过量的FeCl3;
③用已知浓度的K2Cr2O7滴定生成的Fe2+,发生的反应为:
6FeCl2 + K2Cr2O7 + 14HCl 6FeCl3 + 2KCl + 2CrCl3 +7H2O
6FeCl3 + 2KCl + 2CrCl3 +7H2O
现取0.80 g锡粉,经上述各步反应后,共用去0.1000 mol/L K2Cr2O7溶液20.00mL。则锡粉中锡的纯度为_______________。
-
硫酸亚锡(SnSO4)是一种重要的硫酸盐,广泛应用于镀锡工业。某研究小组设计SnSO4制备路线如下:
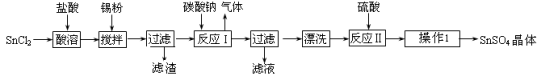
查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成碱式氯化亚锡[Sn(OH)Cl]。
回答下列问题:
(1)锡元素在周期表中位于第五周期,与碳元素位于同一主族,则锡元素的原子的核电荷数为_______。
(2)操作Ⅰ是_________、冷却结晶________、洗涤、干燥。。
(3)SnCl2粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因___________________________。
(4)加入Sn粉的作用有两个:①调节溶液pH,②__________________________。
(5)酸性条件下,SnSO4还可以作双氧水去除剂,发生反应的离子方程式是___________。
(6)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn + 2HCl=SnCl2 + H2↑;
②加入过量的FeCl3 ;
③用已知浓度的K2Cr2O7滴定生成的Fe2+,发生的反应为:
6FeCl2 + K2Cr2O7 + 14HCl =6FeCl3 + 2KCl + 2CrCl3 +7H2O
取1.19g 锡粉,经上述各步反应后,共用去0.100 mol/L K2Cr2O7溶液32.0 ml。锡粉中锡的质量分数是___________________。
-
硫酸亚锡(SnSO4)是一种重要的硫酸盐,广泛应用于镀锡工业.某研究小组设计SnSO4制备路线如下:
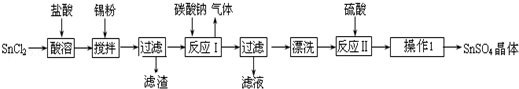
查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化
Ⅱ.SnCl2易水解生成碱式氯化亚锡,Sn相对原子质量为119
回答下列问题:
(1)锡原子的核电荷数为50,与碳元素属于同一主族,锡元素在周期表中的位置是 .
(2)操作Ⅰ是 过滤洗涤.
(3)SnCl2粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因 .
(4)加入Sn粉的作用有两个:①调节溶液pH ② .
(5)反应Ⅰ得到沉淀是SnO,得到该沉淀的离子反应方程式是 .
(6)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是 .
(7)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn+2HCl═SnCl2+H2↑;
②加入过量的FeCl3;
③用已知浓度的K2Cr2O7滴定生成的Fe2+,发生的反应为:6FeCl2+K2Cr2O7+14HCl═6FeCl3+2KCl+2CrCl3+7H2O
取1.226g 锡粉,经上述各步反应后,共用去0.100mol/L K2Cr2O7溶液32.0ml.
锡粉中锡的纯度是 .
-
硫酸亚锡(SnSO4)是一种重要的硫酸盐,广泛应用于镀锡工业。某研究小组设计SnSO4制备路线如下:
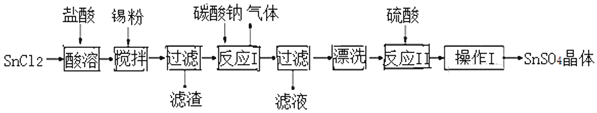
查阅资料:Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成碱式氯化亚锡。(Sn: 119)
回答下列问题:
(1) 操作Ⅰ是________、过滤洗涤。
(2)SnCl2粉末需加浓盐酸进行溶解,目的是_______________________________。
(3)加入Sn粉的作用有两个:①调节溶液pH,②____________________________。[
(4)反应Ⅰ得到沉淀是SnO,得到该沉淀的离子反应方程式是___________________。
(5)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn + 2HCl SnCl2 + H2↑;
SnCl2 + H2↑;
②加入过量的FeCl3;
③用已知浓度的K2Cr2O7滴定生成的Fe2+,发生的反应为:
6FeCl2 + K2Cr2O7 + 14HCl 6FeCl3 + 2KCl + 2CrCl3 +7H2O
6FeCl3 + 2KCl + 2CrCl3 +7H2O
现取0.80 g锡粉,经上述各步反应后,共用去0.1000 mol/L K2Cr2O7溶液20.00mL。则锡粉中锡的纯度为_______________。

SnCl2 + H2↑;
6FeCl3 + 2KCl + 2CrCl3 +7H2O