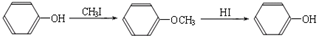
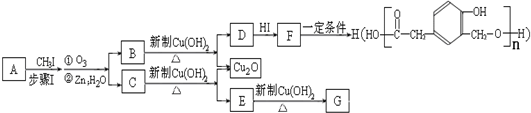
-
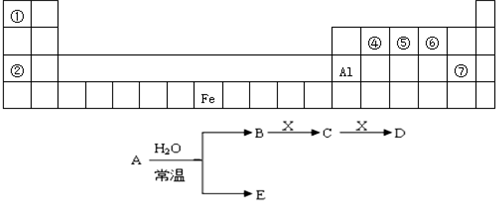
下列说法中不正确的是( )
①铝和铜具有良好的导电性,所以电工操作时,可以把铜线和铝线绞接在一起;
②汽车尾气中含有能污染空气的氮的氧化物,原因是汽油燃烧不充分
③用新制备的Cu(OH)2悬浊液与病人尿液共热,可检验病人尿液中是否含有葡萄糖;
④某雨水样品采集后放一段时间,pH值由4.68变为4.28,是因为水中溶解了较多CO2
⑤明矾可以用于净水,主要是由于铝离子可以水解得到氢氧化铝;
⑥“水滴石穿”主要是溶解了CO2的雨水与CaCO3长期作用生成了可溶性的Ca(HCO3)2的缘故.
A.②③⑤
B.①②④
C.③④⑥
D.③④⑤难度: 中等查看答案及解析
-
下列对实验现象或结论的预测正确的是( )
A.向苯酚钠溶液中通入CO2,溶液变浑浊,继续通入CO2至过量,又变澄清
B.向银氨溶液中滴加盐酸至过量,开始有沉淀出现,后来沉淀又溶解
C.向NaAlO2溶液中通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失
D.向NaOH溶液中通入足量CO2,再加入少量Ba(OH)2溶液,CO32-浓度增大难度: 中等查看答案及解析
-
下列离子方程式表达正确的是( )
A.氯化铁溶液中滴加HI溶液:2Fe3++2HI=2Fe2++2H++I2
B.1mol/L的NaAlO2溶液和2.5mol/L的HCl等体积互相均匀混合:2AlO2-+5H+=Al(OH)3↓+Al3++H2O
C.向NaAlO2溶液中通入过量CO2制Al(OH)3:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
D.向硫酸铝铵[NH4Al(SO4)2]溶液中滴加少量Ba(OH)2溶液:NH4++Al3++2SO42-+2Ba2++5OH-=AlO2-+2BaSO4↓+NH3•H2O+2H2O难度: 中等查看答案及解析
-
下列叙述错误的是( )
A.把a L 0.1 mol/L 的CH3COOH溶液与b L 0.1 mol/L的 KOH溶液混合,所得溶液中一定存在:c(K+)+c(H+)=c (CH3COO-)+c(OH-)
B.把0.1 mol/L 的NaHCO3溶液与0.3 mol/L 的Ba(OH)2溶液等体积混合,所得溶液中一定存在:c(OH-)>c(Ba+)>c(Na+)>c(H+)
C.向1 mol/L 的CH3COOH溶液中加入少量CH3COONa固体,由于CH3COONa水解显碱性,所以溶液的pH升高
D.常温下,在pH=3的CH3COOH溶液和pH=11的NaOH溶液中,水的电离程度相同难度: 中等查看答案及解析
-
下列图示与对应的叙述不相符的是( )

A.图1表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液
B.图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
C.图3表示0.1000mol•L-1NaOH溶液滴定20.00mL0.1000mol•L-1醋酸溶液得到滴定曲线
D.图4 表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化难度: 中等查看答案及解析
-
向一定量的Cu、Fe2O3的混合物中加入300mL 1mol•L-1的盐酸溶液,恰好使混合物完全溶解,所得溶液中不含Fe3+,若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为( )
A.2.4g
B.4.8g
C.6.4g
D.1.6g难度: 中等查看答案及解析
-
天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂.关于维生素P的叙述正确的是( )

A.若R为甲基则该物质的分子式可以表示为C16H10O7
B.分子中有三个苯环
C.1mol该化合物与NaOH溶液作用消耗NaOH的物质的量以及与氢气加成所需的氢气的物质的量分别是4 mol、8 mol
D.1mol该化合物最多可与5molBr2完全反应难度: 中等查看答案及解析
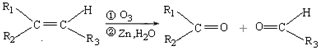 (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)