-
保护环境是每一个公民的责任和义务。下列做法中,有利于保护环境的是
①在农田中焚烧植物秸秆 ②城市生活垃圾分类处理 ③集中掩埋废旧电池 ④限制使用一次性塑料购物袋 ⑤推广使用燃煤脱硫技术
A.②④⑤ B.①②④⑤ C.②③④⑤ D.①②③④⑤
难度: 简单查看答案及解析
-
结合SO2的特点,分析以下对SO2的物质分类及其性质的预测中,不正确的是
①碱性氧化物 可与烧碱反应生成盐和水 ② 非电解质 熔融状态不导电
③电解质 水溶液能导电 ④ 酸性氧化物 可与水反应生成酸
A.①② B.③④ C.①③ D.②④
难度: 简单查看答案及解析
-
某同学在配制500 mL 0.5 mol/L NaOH溶液的实验过程中,除用到玻璃棒、烧杯、500mL容量瓶、量筒、胶头滴管、试剂瓶之外,还需要的主要仪器有
A.温度计 B.天平 C.蒸发皿 D.酒精灯
难度: 简单查看答案及解析
-
用光洁铂丝蘸取某无色溶液,在无色火焰上灼烧,火焰呈黄色,则无色溶液中
A.只有Na+ B.一定有Na+,可能有K+
C.一定有Na+和K+ D.可能有Na+和K+
难度: 简单查看答案及解析
-
下列反应中属于氧化还原反应,且水作为氧化剂的是
A.Cl2 + H2O = HCl + HClO B.2F2 + 2H2O = 4HF + O2
C.2Na + 2H2O = 2NaOH + H2↑ D.2Na2O2 + 2H2O = 4NaOH + O2↑
难度: 简单查看答案及解析
-
下列过程没有起到氮的固定作用的是
A.N2与O2反应生成NO
B.NH3经催化氧化生成NO
C.N2和H2在一定条件下合成氨
D.豆科植物的根瘤菌将空气中的氮气转化为含氮化合物
难度: 简单查看答案及解析
-
储存浓H2SO4的铁罐外口出现严重的腐蚀现象,这体现了浓硫酸的
A.吸水性和酸性 B.脱水性和吸水性
C.强氧化性和吸水性 D.不挥发性和酸性
难度: 简单查看答案及解析
-
甲、乙、丙、丁分别是Al2(SO4)3、FeCl2、NaOH、BaCl2四种物质中的一种。若将丁溶液滴入乙溶液中,发现有白色沉淀生成,继续滴加则沉淀消失,丁溶液滴入甲溶液时,无明显现象发生。据此可推断丙物质是
A.Al2(SO4)3 B.NaOH C.BaCl2 D.FeCl2
难度: 简单查看答案及解析
-
实验室中的药品常按物质的性质、类别不同而有规律的保管着。在做“酸的性质”实验时,实验桌上的部分药品的摆放如图所示。某同学取用KOH溶液以后应把它放回A、B、C、D四处中的
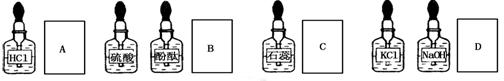
难度: 简单查看答案及解析
-
物质A里只有1×1022个同种分子,在这些分子里共含有2×1022个原子,那么A物质一定是
A.单质 B.化合物 C.纯净物 D.混合物
难度: 简单查看答案及解析
-
如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了。则液体A和气体B的组合不可能是下列的
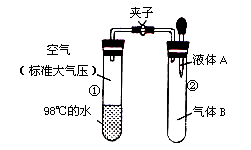
A.蒸馏水、氯化氢
B.盐酸、氨气
C.石灰水、二氧化硫
D.氢氧化钠溶液、一氧化碳
难度: 简单查看答案及解析
-
下列各组离子能在溶液中大量共存的是
A.Fe3+、H+、Cl-、SCN- B.Fe2+、SO42-、H+、NO3-
C.Ba2+、HCO3-、Cl-、Na+ D.K+、NH4+、SO42-、OH-
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.0.1mol·L-1稀硫酸中含有SO42-离子个数为0.1NA
B.常温常压下,46g NO2和N2O4混合气体中含有的原子数为3NA
C.标准状况下,22.4LSO3所含的分子数为NA
D.常温下,2.7g铝与足量的盐酸反应,铝得到的电子数为0.3NA
难度: 简单查看答案及解析
-
下列物质之间的转化都一步能实现的是
A.Si→SiO2→H2SiO3→Na2SiO3
B.Al→Al2O3→Al(OH)3→NaAlO2
C.N2→NH3→NO→NO2→HNO3→NO2
D.S→SO3→H2SO4→SO2→Na2SO3→Na2SO4
难度: 简单查看答案及解析
-
下列各组中的两种物质相互作用时,反应条件(温度、反应物用量比)改变,不会引起产物的种类改变的是
A.Na和O2 B.NaOH和CO2 C.Na2O2和CO2 D.Cu和HNO3
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是
A.二氧化硅与烧碱溶液反应: SiO2 + 2OH- = SiO32- + H2O
B.实验室用大理石和稀盐酸制取二氧化碳:2H+ + CO32- = CO2 ↑ + H2O
C.铜与浓硝酸反应:Cu + 4HNO3(浓) = Cu2+ + 2NO3- + 2NO2↑+ 2H2O
D.工业上将Cl2通入石灰乳中生产漂白粉:2OH- + Cl2 = Cl- + ClO- + H2O
难度: 简单查看答案及解析
-
等质量的①CH4 ②H2 ③H2O ④SO2,在标况下体积由大到小顺序排列的是
A.④>③>①>② B.②>①>④>③
C.②>①>③>④ D.③>④>①>②
难度: 简单查看答案及解析
-
具备基本的化学实验技能是进行科学探究的基础和保证。下列实验装置或操作正确的是

难度: 简单查看答案及解析
-
把4.48LCO2通过一定量的过氧化钠固体后收集到3.36L气体(气体的测量均在标准状况下),则这3.36L气体的质量是
A.6.0g B.5.6g C.4.8g D.3.8g
难度: 简单查看答案及解析
-
研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法可以收到的直观形象的效果。下列表达不正确的是
A.分散质粒子直径与分散系种类:
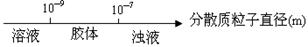
B.NaOH溶液与CO2反应后溶液中的钠盐:

C.AlCl3溶液中滴加氨水后铝的存在形式:

D.Na与O2反应的产物:
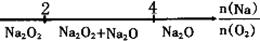
难度: 简单查看答案及解析
-
.对于某些常见离子的检验及结论一定正确的是
A.加入稀盐酸产生无色无味气体,将气体通入澄清石灰水中,溶液变浑浊,则原溶液中一定有CO32-
B.向某溶液中通入Cl2,然后再加入KSCN溶液变红色,说明原溶液中有Fe2+
C.加入氢氧化钠溶液并加热,产生能使湿润的红色石蕊试纸变蓝的气体,则原溶液中一定有NH4+
D.加入稀盐酸酸化的AgNO3溶液,产生白色沉淀,则原溶液中一定含有Cl-
难度: 简单查看答案及解析
-
右图装置中,干燥烧瓶中盛有某种气体a,烧杯和滴管内盛有某种溶液b。挤压滴管的胶头,下列与实验事实不相符的是

气体a
溶液b
实验现象
A
SO2
NaOH溶液
无色喷泉
B
NH3
H2O含紫色石蕊
蓝色喷泉
C
HCl
H2O含紫色石蕊
红色喷泉
D
C12
饱和食盐水
无色喷泉
难度: 简单查看答案及解析
-
如图所示,试管中盛装的是红棕色气体(可能是混合物),当倒扣在盛有水的水槽中时,试管内水面上升,但不能充满试管,当向试管内鼓入氧气后,可以观察到试管中水柱继续上升,经过多次重复后,试管内完全被水充满。原来试管中盛装的不可能是

A.N2与NO2的混和气体 B.O2与NO2的混和气体
C.NO与NO2的混和气体 D.NO2气体
难度: 简单查看答案及解析
-
标准状况下,将一个充满Cl2的试管倒置于盛有水的水槽中,经过足够长时间的光照后,则试管中主要溶质(设生成物全部留在试管中)的物质的量浓度为
A.
mol/L B.
mol/L C.
mol/L D.
mol/L
难度: 简单查看答案及解析
-
将1.92gCu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12L(标准状况),则反应中消耗HNO3的物质的量为
A.1mol B.0.05mol C.1.05mol D.0.11mol
难度: 简单查看答案及解析

