-
化学平衡主要研究下列哪一类反应的规律( )
A.部分反应 B.任何反应 C.可逆反应 D.气体反应
难度: 简单查看答案及解析
-
已知1.2 g C(石墨)不完全燃烧生成CO,放出11.1 kJ热量,继续燃烧又放出28.3 kJ热量。则能表示C(石墨)燃烧热的热化学方程式为
A.C(石墨)+1/2O2(g)====CO(g); △H=-11.1kJ·mol-1
B.C(石墨)+1/2O2(g)====CO(g); △H=-111.1kJ·mol-1
C.C(石墨)+O2(g)====CO2(g); △H=-394kJ·mol-1
D.C(石墨)+O2(g)====CO2(g); △H=-28.3kJ·mol-1
难度: 中等查看答案及解析
-
下列有关化学反应速率与化学反应限度的叙述中,错误的是
A.化学反应速率是表示化学反应快慢的物理量
B.一般情况下,升高温度能加快化学反应速率
C.可逆反应达到化学反应限度时,反应就静止不动了
D.可逆反应达到化学反应限度时,正反应速率等于逆反应速率
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.焓变是指1 mol物质参加反应时的能量变化
B.当反应放热时ΔH>0,反应吸热时ΔH<0
C.在加热条件下发生的反应均为吸热反应
D.一个化学反应中,当反应物总能量大于生成物总能量时,ΔH为“-”
难度: 中等查看答案及解析
-
用相关化学知识进行判断,下列结论错误的是
A.某吸热反应能自发进行,因此该反应是熵增反应
B.NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中
C.可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底
D.增大反应物浓度可加快反应速度,因此用浓硫酸与铁反应能增大生成H2的速率
难度: 中等查看答案及解析
-
已知25 ℃、101 kPa条件下:3O2(g)=2O3(g) ΔH=+284.2 kJ·mol-1下列说法正确的是
A.等质量的O2比O3能量低,由O2变O3为吸热反应
B.等质量的O2比O3能量高,由O2变O3为放热反应
C.O3比O2稳定,由O2变O3为吸热反应
D.O2比O3稳定,由O2变O3为放热反应
难度: 中等查看答案及解析
-
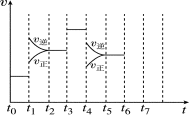
已知可逆反应:4NH3(g)+5O2(g)
4NO(g)+6H2O(g)△H=-1025kJ.mo1-1,若反应物起始物质的量相同,下列关于该反应的示意图不正确的是( )
A.
 B.
B. C.
C. D.
D.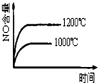
难度: 中等查看答案及解析
-
在体积为V L的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应H2(g)+Br2(g)
2HBr(g);ΔH<0。当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示。下列说法正确的是
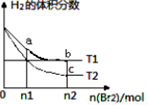
A.若b、c两点的平衡常数分别为K1、K2,则K1>K2
B.a、b两点的反应速率:b>a
C.为了提高Br2(g)的转化率可采取增加Br2(g)通入量的方法
D.b、c两点的HBr的体积分数b>c
难度: 困难查看答案及解析
-
下列事实不能用勒夏特列原理解释的是( )
A. 工业合成氨中,将氨气液化分离以提高氨气产率
B. 开启啤酒瓶后,瓶中马上泛起大量泡沫
C. 实验室中常用排饱和食盐水的方法收集氯气
D. 两支试管中分别加入等体积5%的H3O2溶液,在其中一支试管中加入2~3滴FeCl3溶液,该试管中产生气泡快
难度: 中等查看答案及解析
-
在25℃时,将气体X、Y放入密闭容器中发生反应生成Z,5min后达到平衡。其初始浓度和平衡浓度如下表:下列说法错误的是
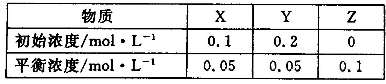
A.该反应可表示为 X+3Y
2Z
B.反应达到平衡时,X的转化率为50%
C.前5min 以Y表示的平均反应速率为υ(Y)= 0.01 mol·L-1·min-1
D.增大压强使平衡向生成Z的方向移动
难度: 中等查看答案及解析
-
将4mol A气体和2mol B气体在2L的密闭容器内混合,并在一定条件下发生如下反应:2A(g)+B(g)
2C(g),若经2s后测得C的浓度为0.6mol·L-1,现有下列几种说法:
①用物质A表示的反应的平均速率为0.3mol·L-1·s-1
②用物质B表示的反应的平均速率为0.6mol·L-1·s-1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7mol·L-1
其中正确的是
A.①③ B.①④ C.②③ D.③④
难度: 中等查看答案及解析
-
某温度下,体积一定的密闭容器中进行如下可逆反应X(g)+Y(g)
Z(g)+W(s) ΔH>0。下列叙述中,正确的是( )
A.加入少量W,逆反应速率增大
B.当容器中气体压强不变时,反应达到平衡
C.升高温度,平衡逆向移动
D.改变条件,又达新平衡,此时上述反应的平衡常数K值一定增大
难度: 简单查看答案及解析
-
恒容密闭容器中进行的可逆反应2NO2
2NO+O2,达到平衡状态的是
①单位时间内生成a mo1 O2的同时生成2a mol NO2
②单位时间内生成a mol O2的同时生成2a molNO
③混合气体的颜色不再改变
④混合气体的密度不再改变的状态
⑤混合气体的平均相对分子质量不再改变的状态
A.①③④ B.②④⑤ C.①③⑤ D.①②③④⑤
难度: 中等查看答案及解析
-
可逆反应:N2(g)+3H2(g)
2NH3(g)的正逆反应速率可用反应物或生成物的浓度变化来表示,下列各关系中能说明反应已达平衡状态的是( )
A.v正(N2)=v正(H2) B.v正(N2)=v逆(NH3)
C.2 v正(H2)=3v逆(NH3) D.v正(N2)=v逆(H2)
难度: 中等查看答案及解析
-
在一定体积的密闭容器中放入3 L气体R和5 L气体Q,在一定条件下发生反应:2R(g)+5Q(g)
4X(g)+nY(g)。反应完全后,容器温度不变,混合气体的压强是原来的87.5%,则化学方程式中的n值是
A.2 B.3 C.4 D.5
难度: 中等查看答案及解析
-
强酸与
强碱在稀溶液中发生中和反应的热化学方程式为H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,向3份同体积0.2 mol ·L-1的NaOH溶液中分别加入适量的稀醋酸、浓硫酸、稀硝酸,恰好完全反应的热效应ΔH1、ΔH2、ΔH3的关系正确的是 ( )
A.ΔH1>ΔH2>ΔH3 B.ΔH2>ΔH3>ΔH1
C.ΔH2>ΔH1>ΔH3 D.ΔH1>ΔH3>ΔH2
难度: 简单查看答案及解析
-
某一反应在一定条件下的平衡转化率为25.3%,当有一催化剂存在时,其转化率为()
A. 大于25.3% B. 小于25.3% C. 等于25.3% D. 无法确定
难度: 困难查看答案及解析
-
下列有关反应能量变化图象的判断错误的是( )
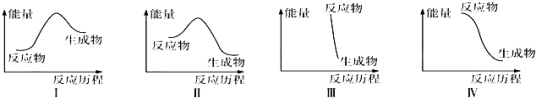
A.Ⅰ可表示需加热的放热反应
B.Ⅱ可表示需加热的放热反应
C.Ⅲ可表示爆炸反应
D.Ⅳ可表示醋酸和碱的中和反应
难度: 中等查看答案及解析
-
已知反应 2SO2 (g) + O2 (g)
2SO3 (g) ∆H < 0,下列说法不正确的是
A.升高温度,正、逆反应速率均加快
B.增大压强,化学平衡正向移动
C.充入O2,可提高SO2的转化率
D.当气体总质量不变时,反应达平衡状态
难度: 简单查看答案及解析
-
在2A+B
3C+4D中,表示该反应速率最快的是( )
A.v(A) = 0.7mol·L-1·S-1 B.v(B) = 0.3 mol·L-1·S-1
C.v(C) = 0.8mol·L-1·S-1 D.v(D) = 1 mol·L-1·S-1
难度: 简单查看答案及解析