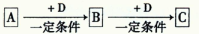-
今年3月修订的《环境空气质量标准》中新纳入的强制监测指标是( )
A.PM2.5 B.NOx C.SO2 D.可吸入颗粒物
难度: 简单查看答案及解析
-
下列用品的有效成分及用途对应错误的是( )
A
B
C
D
用品
有效成分
NaCl
Na2CO3
Al(OH)3
Ca(ClO)2
用途
做调味品
做发酵粉
做抗酸药
做消毒剂
难度: 简单查看答案及解析
-
“化学,让生活更美好”,下列叙述不能直接体现这一主旨的是( )
A. 风力发电,让能源更清洁 B.合成光纤,让通讯更快捷
C.合成药物,让人类更健康 D.环保涂料,让环境更宜居
难度: 简单查看答案及解析
-
将0.195g锌粉加入到20.0mL的0.100 mol·L-1MO2+溶液中,恰好完全反应,则还原产物可能是( )
A.M B.M2+ C.M3+ D.MO2+
难度: 简单查看答案及解析
-
可以验证硫元素的非金属性比氯元素弱的事实是( )
①H2S水溶液是弱酸,HCl水溶液是强酸 ②向氢硫酸溶液中滴入氯水有单质硫生成 ③硫、氯气分别与铜和铁反应,其产物是FeS、Cu2S、FeCl3、CuCl2
④高氯酸(HClO4)的酸性比硫酸强
A.①②④ B.②④ C.②③④ D.①②③④
难度: 简单查看答案及解析
-
一定量的质量分数为14%的KOH溶液,若蒸发掉100 g水后,其质量分数变为28%,体积为125 mL,且蒸发过程中无晶体析出,则浓缩后的KOH溶液的物质的量浓度为( )
A.2.2 mol·L-1 B.4 mol·L-1
C.5 mol·L-1 D.6.25 mol·L-1
难度: 简单查看答案及解析
-
分类是化学研究中常用的方法。下列分类方法中,不正确的是( )
①根据元素原子最外层电子数的多少将元素分为金属和非金属
②根据电解质在水溶液中能否完全电离将电解质分为强电解质和弱电解质
③依据组成元素的种类,将纯净物分为单质和化合物
④根据酸分子中含有的氢原子个数,将酸分为一元酸、二元酸等
⑤根据氧化物中是否含有金属元素,将氧化物分为碱性氧化物、酸性氧化物
⑥根据分散系的稳定性大小,将分散系分为胶体、浊液和溶液
⑦依据有无电子转移,将化学反应分为氧化还原反应和非氧化还原反应
⑧根据化学反应的热效应,将化学反应分为放热反应、吸热反应
A.①④⑤⑥ B.③④⑤⑥ C.只有①③ D.全部正确
难度: 简单查看答案及解析
-
下列关于溶液和胶体的叙述,正确的是( )
A.溶液是电中性的,胶体是带电的。
B.一束光线分别通过溶液和胶体时,后者会出现明显光带,前者则没有。
C.溶液中溶质粒子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动。
D.通电时,溶液中的溶质粒子不会向两极移动,胶体的分散质粒子向某一极移动。
难度: 简单查看答案及解析
-
甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如下图所示(某些条件和部分产物已略去)。下列说法不正确的是( )
A. 若甲既能与盐酸反应又能与NaOH溶液反应,则丙可能属于两性氧化物
B. 若甲为短周期中原子半径最大的主族元素的单质,且戊为碱,则丙只能为Na2O2
C. 若丙、丁混合产生白烟,且丙为18电子分子,丁为10电子分子,则乙的水溶液可能具有漂白作用
D. 若甲、丙、戊含有同一种元素,则三种物质中,该元素的化合价由低到高的顺序可能为:甲 < 丙 < 戊
难度: 简单查看答案及解析
-
下列离子组一定能大量共存的是( )
A.甲基橙呈黄色的溶液中:I-、Cl-、NO3-、Na+
B.石蕊呈蓝色的溶液中:Na+、AlO2-、NO3-、HCO3-
C.含大量Al3+的溶液中:K+、Na+、NO3-、ClO-
D.含大量OH一的溶液中:CO32-、Cl-、F-、K+
难度: 简单查看答案及解析
-
下列离子方程式正确的是( )
A.钠与水反应:Na + 2H2O = Na+ + 2OH- + H2↑
B.硅酸钠溶液与醋酸溶液混合:SiO32- + 2H+ = H2SiO3↓
C.0.01mol/LNH4Al(SO4)2溶液与0.02mol/LBa(OH)2溶液等体积混合:
NH4+ +Al3+ + 2SO42- + 2Ba2+ + 4OH- = 2BaSO4↓ + Al(OH)3↓ + NH3·H2O
D.浓硝酸中加入过量铁粉并加热:Fe + 3NO3- + 6H+
Fe3+ + 3NO2↑ + 3H2O
难度: 简单查看答案及解析
-
科学家最近研制出可望成为高效火箭推进剂的N(NO2)3(如下图所示)。已知该分子中N-N-N键角都是108.1°,下列有关N(NO2)3的说法正确的是( )

A.分子中N、O间形成的共价键是非极性键
B.分子中四个氮原子共平面
C.该物质既有氧化性又有还原性
D.15.2 g该物质含有6.02×1022个原子
难度: 简单查看答案及解析
-
水溶液X中只可能溶有
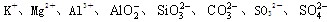 中的若干种离子。某同学对该溶有进行了如下实验:
中的若干种离子。某同学对该溶有进行了如下实验: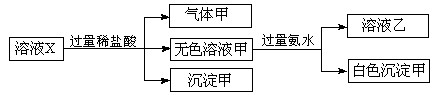
下列判断正确的是( )
A.气体甲一定是纯净物
B.沉淀甲是硅酸和硅酸镁的混合物
C.
 一定存在于溶液X中
一定存在于溶液X中D.
一定不存在于溶液X中
难度: 简单查看答案及解析
-
一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为:CH3CH2OH – 4e- + H2O = CH3COOH + 4H+。下列有关说法正确的是( )
A.检测时,电解质溶液中的H+向负极移动
B.若有0.4mol电子转移,则在标准状况下消耗4.48L氧气
C.电池反应的化学方程式为:CH3CH2OH + O2 = CH3COOH + H2O
D.正极上发生的反应为:O2 + 4e- + 2H2O = 4OH-
难度: 简单查看答案及解析
-
下列与金属腐蚀有关的说法正确的是( )

A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,Zn - MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
难度: 简单查看答案及解析
-
以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下,下列说法不正确的是( )
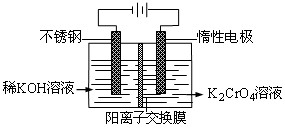
A.在阴极区,发生的电极反应为:2H2O+2e-==2OH―+H2↑
B.在阳极区,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡
 向右移动
向右移动C.该制备过程总反应的化学方程式为:4K2CrO4+4H2O
2K2Cr2O7+4KOH+2H2↑+2O2↑
D.测定阳极液中K和Cr的含量,若K与Cr的物质的量之比为d,则此时铬酸钾的转化率为α=d/2
难度: 简单查看答案及解析