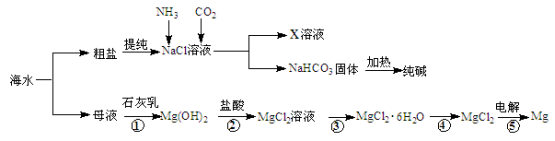
-
保护环境是我国一项基本国策。下列做法中,有利于环保的是
A.推广使用清洁能源 B.将硫酸工厂尾气的烟囱加高
C.任意排放污水 D.在田间焚烧大量秸秆
难度: 简单查看答案及解析
-
下列化学用语正确的是
A.中子数为20的氯原子:
B.硫酸的电离方程式:H2SO4=H2++SO42—
C.漂白粉的有效成分:CaCl2
D.明矾的化学式:KAl(SO4)2•12H2O
难度: 中等查看答案及解析
-
下列生活常见现象中,没有涉及化学变化的是
A.光合作用 B.海水晒盐 C.铁钉生锈 D.石灰岩风化
难度: 简单查看答案及解析
-
体操运动员比赛时为了防滑,常在手掌上涂抹碳酸镁粉末。碳酸镁属于
A.酸 B.碱 C.盐 D.氧化物
难度: 简单查看答案及解析
-
下列关于
和
的说法正确的是
A.质量数相同 B.中子数相同 C.互为同位素 D.核外电子数不同
难度: 简单查看答案及解析
-
下列有关物质用途的说法正确的是
A.碳酸钠治疗胃酸过多 B.稀硫酸除铁锈
C.晶体硅用于制光导纤维 D.二氧化硫用于漂白滋补品银耳
难度: 中等查看答案及解析
-
下列溶液中,与100 mL 0.5 mol/L NaCl溶液所含的Cl- 物质的量浓度相同的是
A.100 mL 0.5 mol/L MgCl2溶液 B.200 mL 0.25 mol/L AlCl3溶液
C.50 ml 1 mol/L NaCl溶液 D.25 ml 0.5 mol/L HCl溶液
难度: 中等查看答案及解析
-
下列物质属于电解质的是
A.酒精 B.食盐水 C.铁 D.氢氧化钠
难度: 简单查看答案及解析
-
下列除去杂质的方法中,正确的是
选项 物质(括号内为杂质) 试剂 方法
A Cl2(HCl ) NaOH溶液 洗气
B Fe(Al) NaOH溶液 过滤
C CO2(CO) O2 点燃
D KNO3(KOH) FeCl3溶液 过滤
难度: 中等查看答案及解析
-
下列各组离子在溶液中能大量共存的是
A.K+、Na+、SO42-、CO32- B.NH4+、Na+、SO42-、OH-
C.H+、K+、HCO3-、Cl- D.Al3+、K+、OH-、NO3-
难度: 中等查看答案及解析
-
用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移溶液、定容等操作。下列图示对应的操作规范的是
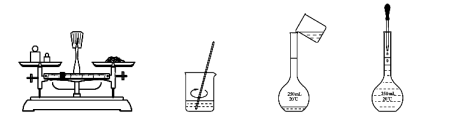
A B C D
难度: 简单查看答案及解析
-
下列有关工业生产的叙述中错误的是
A.电解氯化钠溶液制金属钠
B.石灰石是炼铁和制玻璃的原料之一
C.氯气通入石灰乳中制漂白粉
D.硫酸工业的主要设备有沸腾炉、接触室、吸收塔
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.Cu与FeCl3溶液反应:Cu+ Fe3+= Cu2++ Fe2+
B.碳酸钙溶于稀盐酸:CO32- + 2H+ = H2O + CO2↑
C.FeSO4溶液和NaOH溶液反应: Fe2+ + 2OH- = Fe(OH)2↓
D.氯气溶于水:Cl2 + H2O = 2H+ + ClO- + Cl-
难度: 中等查看答案及解析
-
氮化铝(化学式为AlN,其中Al为+3价)广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN 可通过反应:Al2O3+N2+3C
2AlN+3CO合成。下列叙述正确的是
A.Al2O3是氧化剂 B.N2被氧化
C.AlN的摩尔质量为41 g D.生成1 mol AlN转移3 mol电子
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.标准状况下,22.4 L H2O含有的分子数为 NA
B.28 g N2和N4组成的混合气体中含有的原子数为2 NA
C.1 mol·L-1A1Cl3溶液中含有的Cl-数目为3 NA
D.2.3 g Na与足量水反应,转移的电子数目为0.2 NA
难度: 中等查看答案及解析
-
下列有关物质检验的操作、现象及结论均正确的是
选项 实验操作及现象 实验结论
A 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 该溶液中一定含有SO42-
B 向某溶液中加入稀盐酸,产生的气体通入澄清
石灰水中,变浑浊 该溶液中一定含有CO32-
C 向某溶液中加入NaOH浓溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝 该溶液中一定含有NH4+
D 用洁净的铂丝蘸取少量溶液在酒精灯火焰上灼烧,火焰呈黄色 该溶液一定是钠盐
难度: 中等查看答案及解析
-
下列叙述中正确的是
A.氧化还原反应中得失电子总数一定相等
B.化学反应前后原子的总数一定不变
C.电解质溶液中阴阳离子的总数一定相等
D.分解反应一定是氧化还原反应
难度: 中等查看答案及解析
-
下列各组物质,不能按下图(“→”表示反应一步完成)关系转化的是
选项 a b c
A S SO3 H2SO4
B SiO2 Na2SiO3 H2SiO3
C AlCl3 NaAlO2 Al(OH)3
D Cu CuO Cu(OH)2
难度: 中等查看答案及解析
-
将铁粉放入由盐酸、MgCl2溶液、FeCl3溶液、CuCl2溶液组成的混合液中,充分反应后,铁粉有剩余,则反应后的溶液中含有的大量阳离子是
A.Cu2+ 和Fe2+ B.H+ 和Cu2+ C.Fe3+ 和Fe2+ D. Fe2+ 和Mg2+
难度: 中等查看答案及解析
-
下列装置能达到实验目的是
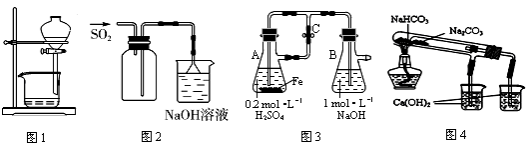
A.图1用于放出碘的四氯化碳溶液
B.图2用于实验室收集SO2
C.图3用于实验室制备Fe(OH)2
D.图4用于比较NaHCO3和Na2CO3热稳定性
难度: 中等查看答案及解析