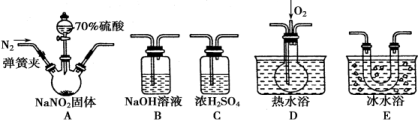
-
糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同。下列分析正确的是
A.脱氧过程是吸热反应,可降低温度延长糕点保质期
B.脱氧过程中铁作原电池负极,电极反应为:Fe-3e-=Fe3+
C.脱氧过程中碳做原电池负极,电极反应为:2H2O+O2+4e-=4OH-
D.含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况)
难度: 中等查看答案及解析
-
下列不能达到实验目的的是
A.将等物质的量的CH4和Cl2在光照下反应生成纯净的CH3Cl
B.将苯与浓硝酸和浓硫酸混合水浴加热制取硝基苯
C.用新制Cu(OH)2悬浊液鉴别葡萄糖和蔗糖
D.用浓硝酸鉴别淀粉溶液和鸡蛋白溶液
难度: 中等查看答案及解析
-
下列物质性质与应用及其对应关系均正确的是
选项
性质
应用
A
碳酸氢钠可与烧碱反应
可用碳酸氢钠作糕点膨松剂
B
AgCl难溶于稀硝酸
可用稀硝酸和AgNO3溶液检测Cl-
C
浓硫酸具有强氧化性,而稀硫酸的氧化性较弱
可用浓硫酸替代稀硫酸与锌反应快速制氢气
D
碳单质性质稳定
可在纯铁中加入少量炭增强抗腐蚀性
难度: 中等查看答案及解析
-
烷基取代苯
可被酸性高锰酸钾溶液氧化为
(苯甲酸),但若烷基R中直接与苯环相连接的碳原子上没有C-H键,则不容易被氧化得到苯甲酸。据此判断,分子式为C11H16的一烷基取代苯,可以被氧化为苯甲酸的异构体共有
A.6种 B.7种 C.8种 D. 9种
难度: 困难查看答案及解析
-
汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3=K2O+5Na2O+16N2↑ ,下列判断正确 的是
A.该反应中KNO3是氧化剂 ,N2是还原产物
B.每生成16 mol N2转移30 mol电子
C.若氧化产物比还原产物多1.75mol ,则转移电子的物质的量为1.25mol
D.该反应中氧化产物与还原产物的质量之比为1:15
难度: 中等查看答案及解析
-
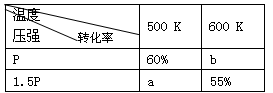
在100℃时,将N2O4、NO2分别充入两个各为1 L的密闭容器中,反应过程中浓度变化如下:[2NO2(g)
N2O4(g) ΔH <0]
容器
物质
起始浓度/(mol·L-1)
平衡浓度/(mol·L-1)
Ⅰ
N2O4
0.100
0.040[
NO2
0
0.120
Ⅱ
N2O4
0
0.014
NO2
0.100
0.072
下列说法正确的是
A.平衡时,Ⅰ、Ⅱ中反应物的转化率α(N2O4)<α(NO2)
B.平衡时,Ⅰ、Ⅱ中上述正反应的平衡常数K(Ⅰ) = 2K(Ⅱ)
C.平衡后,升高相同温度,以N2O4表示的反应速率ν(Ⅰ)<ν(Ⅱ)
D.平衡后,升高温度,Ⅰ、Ⅱ中气体颜色都将变深
难度: 困难查看答案及解析
-
隔膜电解法处理高浓度乙醛废水的原理是使乙醛分别在两极发生反应,转化为乙醇和乙酸。实验室中,以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置示意图如右图所示。有关说法不正确的是
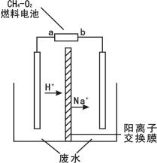
A.图中燃料电池的a极应通入氧气
B.乙醇在阴极产生
C.电解过程中,阴极区有NaOH产生
D.每生成1mol乙酸,理论上至少消耗标况下氧气22.4L
难度: 困难查看答案及解析