-
下列说法正确的是( )
A.热化学方程式中,化学式前面的化学计量数既可表示微粒数,又可表示物质的量
B.热化学方程式中,如果没有注明温度和压强,则表示在标准状况下测得的数据
C.凡是化合反应都是放热反应,分解反应都是吸热反应
D.书写热化学方程式时,不仅要写明反应热的符号和数值,还要注明各物质的聚集状态
难度: 中等查看答案及解析
-
已知下列反应的反应热:
(1)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=-870.3 kJ·mol-1
(2)C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ·mol-1
(3)H2(g)+1/2O2(g)=H2O(l) ΔH3=-285.8 kJ·mol-1
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热为( )
A.ΔH=-488.3 kJ·mol-1 B.ΔH=-244.15 kJ·mol-1
C.ΔH=-977.6 kJ·mol-1 D.ΔH=+488.3 kJ·mol-1
难度: 困难查看答案及解析
-
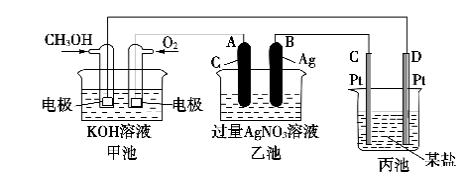
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+O2(g)=CO2(g)+2H2O(g) ΔH=-192.9 kJ·mol-1
下列说法正确的是( )
A.CH3OH的燃烧热为192.9 kJ·mol-1
B.反应①中的能量变化如图所示

C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应CH3OH(l)+O2(g)=CO2(g)+2H2O(g)的ΔH>-192.9 kJ·mol-1
难度: 困难查看答案及解析
-
在气体反应中,能使反应物中活化分子数和活化分子百分数同时增大的方法是( )
①增大反应物的浓度 ②升高温度 ③增大压强 ④移去生成物 ⑤加入催化剂
A.①③⑤ B.②⑤ C.②③⑤ D.①③④
难度: 中等查看答案及解析
-
在恒容的密闭容器中进行的可逆反应A(g)+3B(g)
2C(g)达到平衡的标志是( )
A.C生成的速率和C分解的速率相等
B.单位时间内生成n molA,同时生成3n molB
C.B的消耗速率与C的消耗速率之比为1∶1
D.混合气体密度保持不变
难度: 中等查看答案及解析
-
将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s)
NH3(g)+HI(g) ②2HI(g)
H2(g)+I2(g)。达到平衡时,c(H2)=1 mol·L-1,c(HI)=4 mol·L-1,则此温度下反应①的平衡常数为( )
A.22 B.24 C.20 D.25
难度: 困难查看答案及解析
-
已知热化学方程式:SO2(g)+1/2O2(g)
SO3(g);△H=―98.32kJ/mol,温度相同时,分别向恒容容器和恒压容器中充入1molSO2和0.5molO2充分反应,达平衡后,放出热量分别为:Q1kJ、Q2kJ,则下列关系正确的是( )
A.Q1=Q2=98.32 B.Q1>Q2>98.32 C.Q2<Q1<98.32 D.Q1<Q2<98.32
难度: 中等查看答案及解析
-
在已经处于化学平衡状态的体系中,如果下列量发生变化其中一定能表明平衡移动的是( )
A.反应物的转化率 B.反应混和物的浓度
C.正、逆反应速率 D.反应混和物的压强
难度: 中等查看答案及解析
-
5L容器中充入2molA(g)和1molB(g),在一定条件下发生反应: 2A(g)+B(g)
2C(g),达平衡时,在相同温度下测得容器内混合气体压强是反应前的5/6,则A的转化率为( )
A.67% B.50% C.25% D.5%
难度: 中等查看答案及解析
-
酸碱恰好完全中和时( )
A.酸与碱的物质的量一定相等
B.溶液呈现中性
C.酸与碱的物质的量浓度相等
D.酸所能提供的H+与碱所能提供的OH-的物质的量相等
难度: 简单查看答案及解析
-
在中和滴定实验中用到的仪器,只需用蒸馏水洗净不能用待盛放液体润洗的是( )
A.酸式滴定管 B.碱式滴定管 C.移液管 D.锥形瓶
难度: 简单查看答案及解析
-
相同体积、相同pH的某一元强酸溶液①和某一元中强酸溶液②分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是( )
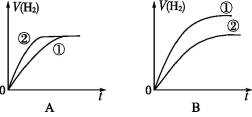
难度: 中等查看答案及解析
-
有关常温下pH均为3的醋酸和硫酸的说法正确的是( )
A.两种溶液中,由水电离出的氢离子浓度均为1×10-11 mol·L-1
B.分别加水稀释100倍后,两种溶液的pH仍相同
C.醋酸中的c(CH3COO-)和硫酸中的c(SO42-)相等
D.分别加入足量锌片,两种溶液生成H2的体积相同
难度: 中等查看答案及解析
-
温度相同,浓度均为0.2 mol·L-1的①(NH4)2SO4,②NaNO3,③NH4HSO4,④NH4NO3,⑤CH3COONa溶液,它们的pH由小到大的排列顺序是( )
A.③①④②⑤ B.①③⑤④② C.③②①⑤④ D.⑤②④①③
难度: 简单查看答案及解析
-
把pH=13的NaOH溶液与pH=2的硫酸溶液混合后,所得溶液的pH=11,则NaOH溶液和硫酸溶液的体积之比为
A .1:1 B.1:5 C.1:9 D.2:3
难度: 困难查看答案及解析
-
常温下,0.1 mol·L-1CH3COONa溶液pH=11,下列表述正确的是( )
A.c(Na+)=c(CH3COO—)
B.c(CH3COO—)+c(CH3COOH)=0.1 mol·L-1
C.由水电离出来的c(OH—)=1.0×10-11 mol·L-1
D.往该溶液中加入0.05 mol·L-1的CH3COONa,pH值变大
难度: 中等查看答案及解析
-
室温下,下列溶液中粒子浓度大小关系正确的是( )
A.Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S)
B.Na2C2O4溶液中:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4)+c(C2O42-)
C.Na2CO3溶液:c(Na+)+c(H+)=2c(CO32-)+c(OH-)
D.CH3COONa和CaCl2混合溶液:c(Na+)+2c(Ca2+)=c(CH3COO-)+c(CH3COOH)+c(Cl-)
难度: 困难查看答案及解析
-
室温下某溶液中由水电离产生的c(H+)等于10-13 mol·L-1,该溶液的溶质不可能是( )
A.NaHSO4 B.NaCl C.HCl D.Ba(OH)2
难度: 简单查看答案及解析
-
在蒸发皿中加热蒸干并灼烧下列物质的溶液,可以得到该溶质的固体物质的是( )
A.氯化铝 B.碳酸氢钠 C.硫酸镁 D.高锰酸钾
难度: 中等查看答案及解析
-
25 ℃时,在20 mL 0.1 mol·L-1 NaOH溶液中逐滴加入0.2 mol·L-1醋酸溶液,曲线如图所示,有关粒子浓度关系的比较中,不正确的是( )
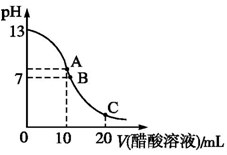
A.在A点:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
B.在B点:c(OH-)=c(H+),c(Na+)=c(CH3COO-)
C.在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.在C点:c(CH3COO-)+c(CH3COOH)=2c(Na+)
难度: 简单查看答案及解析
-
已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13 ,Ksp(Ag2CrO4)=9×10-11。某溶液中含有Cl-、Br-和CrO42-,浓度均为0.010 mol/L,向该溶液中逐滴加入0.010 mol/L的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为 ( )
A.Cl-、Br-、CrO42- B.CrO42-、Br、Cl-
C.Br-、Cl-、CrO42- D.Br、CrO42-、Cl-
难度: 简单查看答案及解析
-
某温度时,BaSO4在水中的沉淀溶解平衡曲线如下图所示。下列说法正确的是( )
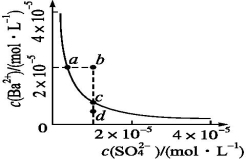
提示:BaSO4(s)
Ba2+(aq)+SO42-(aq)的平衡常数Ksp=c(Ba2+)·c(SO42-),称为溶度积常数。
A.加入Na2SO4可以使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp
难度: 简单查看答案及解析
-
对于原电池的电极名称,叙述错误的是( )
A.发生氧化反应的一极为负极 B.正极为电子流入的一极
C.比较不活泼的金属为负极 D.电流流出的一极为正极
难度: 简单查看答案及解析
-
已知某镍镉(Ni—Cd)电池的电解质溶液为KOH溶液,其放电按下式进行:
Cd+2NiOOH+2H2O=Cd(OH)2+2Ni(OH)2。有关该电池的说法正确的是( )
A.充电时阳极反应:NiOOH+H2O+e-===Ni(OH)2+OH-
B.充电过程是电能转化为化学能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
难度: 困难查看答案及解析
-
一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为:CH3CH2OH-4e-+H2O=CH3COOH+4H+。下列有关说法正确的是( )
A.检测时,电解质溶液中的H+向负极移动
B.若有0.4 mol电子转移,则在标准状况下消耗4.48L氧气
C.电池反应的化学方程式为:CH3CH2OH+O2=CH3COOH+H2O
D.正极上发生的反应为:O2+4e-+2H2O=4OH-
难度: 中等查看答案及解析
-
关于镀铜和电解精炼铜,下列说法中正确的是( )
A.都用粗铜作阳极、纯铜作阴极
B.电解液的成分都保持不变
C.阳极反应都只有Cu-2e-=Cu2+
D.阴极反应都只有Cu2++2e-=Cu
难度: 中等查看答案及解析
-
用惰性电极电解下列溶液,其中随着电解的进行,溶液pH逐渐减小的是( )
①氯化钠溶液 ②硫酸铜溶液 ③氢氧化钠溶液 ④稀硫酸 ⑤稀盐酸 ⑥硫酸钠溶液
A.①③⑤ B.②④⑤ C.②④ D.②④⑥
难度: 中等查看答案及解析
-
铝和氢氧化钾都是重要的工业产品。工业品氢氧化钾的溶液中含有某些含氧酸杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示,下列说法正确的( )
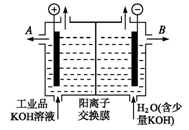
A.阳极产生KOH
B.阴极产生KOH
C.大量H+通过离子交换膜从左侧到右侧
D.大量K+通过离子交换膜从右侧到左侧
难度: 困难查看答案及解析
-
下列金属防腐的措施中,使用外加电流的阴极保护法的是( )
A.水中的钢闸门连接电源的负极 B.金属护栏表面涂漆
C.汽水底盘喷涂高分子膜 D.地下钢管连接镁块
难度: 中等查看答案及解析
-
铁钉和碳棒用导线连接,浸入稀NaCl溶液中,正极发生的反应是( )
A.2H++2e-===H2↑ B.2H2O+O2+4e-===4OH-
C.Fe-2e-===Fe2+ D.4OH--4e-===2H2O+O2↑
难度: 中等查看答案及解析