-
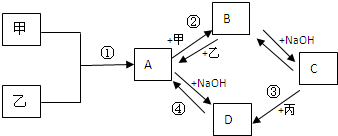
除去NaCl中含有的Ca2+、Mg2+、SO42-、HCO3-等离子,通常采用以下四种试剂:①Na2CO3 ②BaCl2 ③NaOH ④HCl,加入试剂合理的操作顺序是( )
A.①②③④
B.③①②④
C.④②①③
D.③②①④难度: 中等查看答案及解析
-
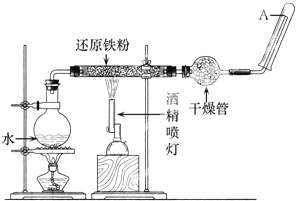
实验室用氯化铵和消石灰制氨气的装置和下列哪种制气装置相同( )
A.加热高锰酸钾制O2
B.石灰石和稀盐酸反应制CO2
C.MnO2催化过氧化氢溶液分解制O2
D.MnO2与浓HCl加热制取氯气难度: 中等查看答案及解析
-
用饱和的FeCl3溶液制取Fe(OH)3胶体,正确的操作是( )
A.将FeCl3溶液滴人蒸馏水中
B.将FeCl3溶液滴人热水中,生成棕黄色液体
C.将FeCl3溶液滴人沸水中,并继续煮沸至生成红褐色液体
D.将FeCl3溶液滴人沸水中,并继续煮沸至生成红褐色沉淀难度: 中等查看答案及解析
-
有关Na2CO3和NaHCO3的性质,下列叙述中错误的是( )
A.等质量的Na2CO3和NaHCO3分别与足量的盐酸反应时,在相同条件下Na2CO3比NaHCO3产生的气体体积小
B.常温时水溶性:Na2CO3>NaHCO3
C.等物质的量的Na2CO3和NaHCO3跟同一种盐酸充分反应时,消耗酸的体积比是2:1
D.将澄清的石灰水分别加入Na2CO3和NaHCO3溶液时,前者产生沉淀,后者不产生沉淀难度: 中等查看答案及解析
-
下列说法正确的是( )
A.第二周期元素从C到F,非金属性逐渐减弱
B.第三周期元素从Na到Cl,原子半径逐渐增大
C.HF、HCl、HBr、HI的热稳定性依次逐渐减弱
D.LiOH、NaOH、KOH的碱性依次逐渐减弱难度: 中等查看答案及解析
-
在8NH3+3Cl2═N2+6NH4Cl反应中,有21.3克氯气参加了反应,则被氧化的NH3的质量是( )
A.13.6克
B.10.2克
C.34克
D.3.4克难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列有关说法不正确的是( )
A.45g水中含有的水分子数是2.5NA
B.标准状况下,33.6LCO中含有的原子数是3NA
C.0.5L0.2mol/L的NaCl(aq)中含有的Na+数是0.1NA
D.1mol CH+3(碳正离子)中含电子数目为10NA难度: 中等查看答案及解析
-
“纳米材料”是粒子直径为1nm~100nm的材料,纳米碳就是其中的一种.某研究所将纳米碳均匀的分散到蒸馏水中,得到的物质①是溶液 ②是胶体 ③具有丁达尔现象 ④不能透过半透膜 ⑤不能透过滤纸 ⑥静止后会出现黑色沉淀.
其中正确的是( )
A.①④⑥
B.②③⑤
C.②③④
D.①③④⑥难度: 中等查看答案及解析
-
现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
A.分液、萃取、蒸馏
B.萃取、蒸馏、分液
C.分液、蒸馏、萃取
D.蒸馏、萃取、分液难度: 中等查看答案及解析
-
用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的是( )
A.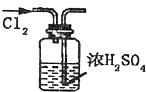
干燥Cl2
B.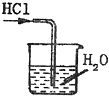
吸收HCl
C.
石油的蒸馏
D.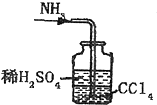
吸收NH3难度: 中等查看答案及解析
-
“绿色化学”的主要内容之一是指从技术、经济上设计可行的化学反应,使原子充分利用,不产生污染物.下列化学反应符合“绿色化学”理念的是( )
A.制CuSO4:Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O
B.制CuSO4:2Cu+O2=2CuO;Cu+H2SO4(稀)=CuSO4+H2O
C.制Cu(NO3)2:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
D.制Cu(NO3)2:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O难度: 中等查看答案及解析
-
已知同周期X、Y、Z三种元素的最高价氧化物对应水化物酸性由强到弱的顺序为HXO4>H2YO4>H3ZO4,则下列判断中正确的是( )
A.元素非金属性按X、Y、Z的顺序减弱
B.阴离子的还原性按X、Y、Z的顺序减弱
C.气态氢化物的稳定性按X、Y、Z的顺序增强
D.单质的氧化性按X、Y、Z的顺序增强难度: 中等查看答案及解析
-
已知某溶液Cl-、Br-、I-的离子数之比为1:2:3,要使溶液Cl-、Br-、I-的离子数之比变为3:2:1,则通入Cl2的分子数与原溶液中I-离子数之比为( )
A.1:2
B.1:3
C.2:1
D.3:1难度: 中等查看答案及解析
-
向下列溶液中,通过量的CO2,溶液出现浑浊的是( )
A.澄清石灰水
B.CaCl2溶液
C.NaAlO2溶液
D.NaHCO3溶液难度: 中等查看答案及解析
-
甲、乙两烧杯中各盛放有100mL 3mol•L-1的盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲:乙=1:2,则加入铝粉的质量为( )
A.5.4g
B.3.6g
C.2.7g
D.1.8g难度: 中等查看答案及解析
-
向澄清石灰水中不断通入二氧化碳气体的过程中,该溶液的导电性的变化是(纵坐标表示导电性,横坐标表示二氧化碳气体的物质的量)( )
A.
B.
C.
D.难度: 中等查看答案及解析
-
在含有agHNO3的稀硝酸中,加入bg铁粉恰好完全反应.若生成的气体只有NO,且有
gHNO3被还原,则a:b不可能的是( )
A.2:1
B.3:1
C.4:1
D.9:2难度: 中等查看答案及解析
-
管道工人曾经用浓氨水检查氯气管道是否漏气.已知能发生如下反应(在有水蒸气存在的条件下)2NH3+3Cl2═6HCl+N2,下列说法中错误的是( )
A.用该方法检验管道泄漏处会产生白烟
B.管道泄漏处会闻到刺激性气味
C.该反应生成1mol氮气时,转移3mol电子
D.可以用浸有稀碱液的布包裹在管道泄漏处,暂时防止氯气的危害难度: 中等查看答案及解析
-
在Al2(SO4)3和MgSO4的混合液中滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如下图所示,则原溶液中Al2(SO4)3和MgSO4的物质的量之比为( )
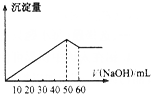
A.1:2
B.3:1
C.3:2
D.2:1难度: 中等查看答案及解析
-
3.2g铜与过量的硝酸(8mol/L,30mL)充分反应,硝酸的还原产物是NO和NO2,反应后溶液中含有amolH+,则此时溶液中含有NO3-的物质的量为( )
A.(0.1+a)mol
B.(0.2+a)mol
C.(0.05+a)mol
D.amol难度: 中等查看答案及解析
-
下列反应的离子方程式不正确的是( )
A.盐酸加入氨水:H++NH3•H2O=NH4++H2O
B.铜片插入硝酸银溶液:Cu+2Ag+═Cu2++2Ag
C.碳酸钙加入醋酸:CO32-+2CH3COOH═CO2↑+2CH3COO-+H2O
D.铜粉加入稀硝酸:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O难度: 中等查看答案及解析
-
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图.关于反应中镁和铝的说法正确的是( )
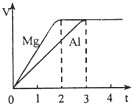
A.质量之比为3:2
B.物质的量之比为4:3
C.摩尔质量之比为2:3
D.消耗硫酸的物质的量之比为1:1难度: 中等查看答案及解析
-
已知I-、Fe2+、SO2、Cl-、H2O2在酸性溶液中的还原性强弱顺序为:SO2>I->H2O2>Fe2+>Cl-,则下列反应不可能发生的是( )
A.H2O2+H2SO4=SO2+O2+2H2O
B.2I-+2Fe3+=I2+2Fe2+
C.2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
D.SO2+2H2O+I2=H2SO4+2HI难度: 中等查看答案及解析