-
工业上制备BaCl2的工艺流程图如下:
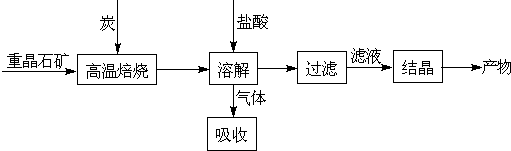
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验.查表得
BaSO4(s)+4C(s)4CO(g)+BaS(s)△H1=571.2kJ•mol-1 ①
BaSO4(s)+2C(s)2CO2(g)+BaS(s)△H2=226.2kJ•mol-1 ②
(1)气体用过量NaOH溶液吸收,得到硫化钠.Na2S水解的离子方程式为______;
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,=______;[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
(3)反应C(s)+CO2(g)2CO(g)的△H2=______kJ•mol-1;
(4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是______.难度: 中等查看答案及解析
-
硅藻土由无定形的SiO2组成,含有少量Fe2O3、Al2O3及有机物等杂质.通常呈浅黄色或浅灰色,质软多孔.工业上可按如下流程,用硅藻土制备纳米二氧化硅.
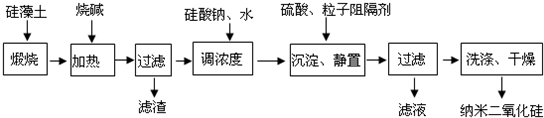
(1)煅烧硅藻土的目的是______
(2)在加热条件下加入烧碱时反应的化学方程式为______.
(3)加入过量硫酸后生成沉淀的反应方程式为______.
(4)上述流程中,有助于控制二氧化硅粒子直径的措施有______(至少写出一个).难度: 中等查看答案及解析
-
某厂为综合利用生产废料石膏,设计如下工艺流程制备硫酸和生石灰.
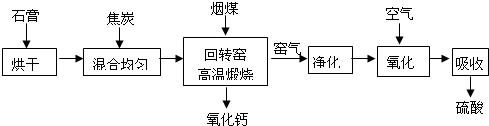
回答下列问题:
(1)窑气中除含有CO2外,还含有的主要物质是______.
(2)窑气经净化后在氧化、吸收过程中发生反应的化学方程式为______.
(3)回转窑内焦炭与硫酸钙反应的化学方程式为______.
(4)此硫酸产品经处理后得到的超纯硫酸是一种非常有效的清洗剂.一定条件下,它几乎可以除去硅晶片上所有的无机残留物与金属颗粒,除去硅晶片上铜颗粒的化学方程式为______.难度: 中等查看答案及解析
-
合成氨工业的反应为:N2(g)+3H2(g)⇌2NH3(g);△H<0工业合成氨生产示意图如图1所示.
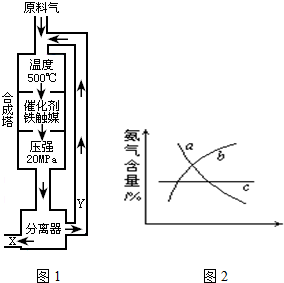
(1)写出该反应的化学平衡常数表达式:K=______.随着温度升高,K值______(填增大、减小、不变)
(2)Y的主要成分为______;
(3)化工生产条件选定的主要原因是(选填字母序号)______;
A.温度、压强对化学平衡的影响;
B.铁触媒在该温度时活性大;
C.工业生产受动力、材料、设备等条件的限制.
(4)改变反应条件,会使平衡发生移动.如图2象表示随条件改变,氨气的百分含量的变化趋势.
当横坐标为压强时,变化趋势正确的是(选填字母序号)______,
当横坐标为温度时,变化趋势正确的是(选填字母序号)______.
(5)合成氨工厂常通过测定反应前后的混合气体密度来确定氮的转化率.某工厂测得合成塔中N2、H2的密度为0.5536g/L(标准状况),从合成塔中出来的混合气体密度为0.693g/L.则该合成氨厂N2的转化率为多少?______.难度: 中等查看答案及解析
-
金属镁可与热水反应生成氢氧化镁,所得溶液成碱性,可使酚酞试液显红色.某同学将镁条放在热水中煮沸,趁热取出部分溶液,滴加酚酞试液,溶液变成红色,放置在空气中一段时间后,发现溶液的红色褪去了.
(1)溶液红色褪去说明溶液的碱性______;
(2)据你推测,导致溶液碱性变化的原因可能是:①______②______;
(3)设计一个实验来证明你的一种推测,简要说明操作、现象、结论.______.难度: 中等查看答案及解析
-
某同学设计和进行了如图试验:
(1)步骤:
①将约0.4g表面光亮的铁丝绒,绕成团,用水浸湿后,放进量筒中;
②将量筒倒置在装有蒸馏水的水槽中,开始量筒内的水面调至10.0mL的刻度处,固定;
③当量筒内的水面不再上升时,停止试验.
(2)请回答:
①铁丝绒表面的变化是______;
②上述①变化的条件是______;
③量筒内水面最后约在______mL刻度处(忽略铁丝体积和上升水柱压强的影响);
④如果你的自行车被雨淋湿后,你采取的防锈措施是______.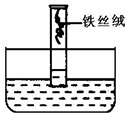
难度: 中等查看答案及解析
-
某研究性学习小组设计实验探究铝等金属的性质:将铝片(不除氧化膜)投入浓氯化铜溶液中,铝表面很快出现一层海绵状暗红色物质,接下来铝片上产生大量气泡.触摸容器知溶液温度迅速上升,收集气体,检验其具有可燃性.若用同样的铝片投入同浓度的硫酸铜溶液中,在短时间内铝片无明显变化.
(1)铝与氯化铜溶液能迅速反应,而与同浓度的硫酸铜溶液在短时间内不反应的原因可能是______.
A.氯化铜溶液酸性比同浓度的硫酸铜溶液酸性强
B.硫酸铜水解生成硫酸使铝钝化
C.氯离子能破坏氧化铝表面薄膜,而硫酸根离子不能
D.生成氯化铝溶于水,而生成硫酸铝不溶于水
请设计一个简单实验验证你的选择:______.
(2)铝片表面出现的暗红色物质的过程中发生的离子反应方程式是______. 用离子方程式解释产生气泡的原因:______.
(3)放出的气体是______,请从有关物质的浓度、能量、是否有电化学作用等分析开始阶段产生气体的速率不断加快的原因是______.(写出一点即可)
(4)某同学通过一定的实验操作,也能使铝片与硫酸铜溶液反应加快,他采取的措施可能是______.
A.用砂纸擦去铝片表面的氧化膜后投入硫酸铜溶液中
B.把铝片投入热氢氧化钠溶液中一段时间后,取出洗涤,再投入硫酸铜溶液中
C.向硫酸铜溶液中滴加氢氧化钠溶液,再投入铝片
D.在铝片上捆上几枚铜钉后投入同浓度的硫酸铜溶液中
(5)除去氧化铝的铝片与铜片为电极,在X电解质溶液中构成原电池,列表如下:
其中正确的是______,由此推知,金属作电极不仅与本身性质相关,而且与______有关.选项 铝电极 电解质 负极反应 正极反应 A 正极 NaOH Al-3e-=Al3+ 2H2O+2e-=2OH-+H2↑ B 负极 稀盐酸 2Al-6e-=2Al3+ 6H++6e-=3H2↑ C 正极 浓硝酸 Cu-2e--=Cu2+ 2NO3-+4H+-4e-=2NO2↑+2H2O D 负极 稀硝酸 Cu-2e-=Cu2+ 2NO3-+8H+=2NO↑+4H2O+6e- 难度: 中等查看答案及解析
-
某兴趣小组去一家回收含铜电缆废料的工厂做社会调查,技术人员向他们展示两个方案,并提出下列问题:
方案甲: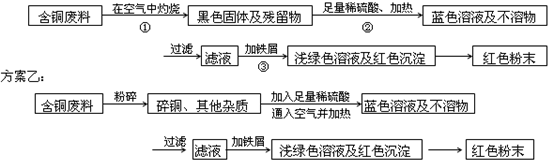
方案乙: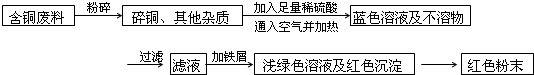
(1)两个方案哪个符合当前的绿色理念:______;
(2)写出方案甲中步骤②、③反应的离子方程式:______、______;
(3)无论是甲还是乙方案,在“加铁屑”时,都加入稍过量的铁屑,你认为这么做的道理是:______;
(4)①用简便的方法检验红色粉末中含有过量的铁屑:______;②如何除去红色粉末中所含过量的Fe得干燥的红色粉末:______.难度: 中等查看答案及解析
-
在中学化学实验中,通常用无水硫酸铜检验少量水的存在.由于无水硫酸铜吸湿性很强,需要现制现用.
方法甲:取2药匙细小的硫酸铜晶体置于______中研碎后放入坩埚,将坩埚放在______上用小火慢慢加热并用玻璃棒不停搅拌,最后将坩埚移入______中进行冷却(请选用合适仪器或设备填空:表面皿、研钵、烧杯、通风橱、试管夹、干燥器、泥三角).
方法乙:取2药匙研碎的硫酸铜晶体于小烧杯中,加入20ml浓硫酸(质量分数不低于98%),并用玻璃棒搅拌,静置5min后倾去浓硫酸,用无水乙醇洗涤数次,倒在滤纸上晾干.
交流与讨论:
(1)方法甲中,加热温度稍高时会出现变黑现象,原因是______ CuO+SO3+5H2O或CuSO4•5H2OCuO+H2SO4+4H2O
难度: 中等查看答案及解析
-
硫酸亚铁铵的化学式为(NH4)2Fe(SO4)2•6H2O,商品名为摩尔盐.硫酸亚铁可与硫酸铵生成硫酸亚铁铵,一般硫酸亚铁盐在空气中易被氧化,而形成摩尔盐后就比较稳定了.三种盐的溶解度(单位为g/100g水)如下表
实验室欲制备硫酸亚铁铵晶体,设计了如下方案.温度/℃ 10 20 30 40 50 70 (NH4)2SO4 73.0 75.4 78.0 81.0 84.5 91.9 FeSO4•7H2O 40.0 48.0 60.0 73.3 - - (NH4)2Fe(SO4)2•6H2O 18.1 21.2 24.5 27.9 31.3 38.5
(1)完成实验步骤中的填空:
①称取4g铁屑,放入小烧杯,加入15mL10%Na2CO3溶液,小火加热10min以除去______,倒掉溶液,用蒸馏水把铁冲洗干净,干燥,备用;
②将处理好的铁屑放入小烧杯,加入15mL 3mol/L H2SO4溶液,水浴加热至不再有气体生成为止,趁热过滤去剩余铁屑,并用少量热水洗涤烧杯及滤纸,并将滤液和洗涤液一起转移到蒸发皿中,则蒸发皿中溶液的溶质为______(填名称,不考虑水解),其物质的量约为______mol;
③加入______g硫酸铵到蒸发皿中,缓缓加热、浓缩至表面出现结晶膜为止、冷却,得硫酸亚铁铵晶体.
(2)回答下列问题:
①硫酸亚铁溶液在空气中易被氧化变质,操作时应注意:a______;b______;
②加热、浓缩溶液时,不浓缩至干的理由是______;
③硫酸亚铁和硫酸铵的混合溶液加热浓缩就能得到硫酸亚铁铵晶体,其原因是______;
④称取两份质量均为1.96g的该硫酸亚铁铵,制成溶液.用未知浓度的KMnO4酸性溶液进行滴定.
Ⅰ) 滴定时,将KMnO4酸性溶液装在______(酸式或碱式)滴定管,操作时用______手拿锥形瓶;
Ⅱ) 已知MnO4-被还原为Mn2+,试写出该滴定过程中的离子方程式:______;
Ⅲ) 判断该反应到达滴定终点的现象为______;
Ⅳ) 假设到达滴定终点时,用去V mL KMnO4酸性溶液,则该KMnO4酸性溶液的浓度为______mol/L.难度: 中等查看答案及解析
-
以下是某实验小组用CO2和NaOH溶液做喷泉实验的装置和测得的一组数据
已知:烧瓶最大容量为250mL,每次实验充分摇动烧瓶,只有NaOH浓度不同,其它条件和操作方式相同.结合喷泉实验原理及你所学的知识,判断下列说法中不正确的是______NaOH浓度(mol/L) 0.4 0.5 0.8 1.0 1.4 1.6 1.8 现象 不能
形成一段
液柱形成喷泉 形成喷泉 形成喷泉 形成喷泉 形成喷泉 形成喷泉 时间 6min 1min 35s 10s 6s 6s 烧瓶中水的体积(mL) 7 41 71 125 240 240
A.CO2在水中的溶解度小,不宜用水直接吸收CO2来做喷泉实验
B.在一定的浓度范围内氢氧化钠溶液的浓度越大越易形成喷泉
C.NaOH浓度为1.6mol/L时,CO2还没有全部分被吸收
D.当氢氧化钠溶液的物质的量浓度为1.0mol/L时所得溶液不可能有氢氧化钠,烧瓶也没有充满.难度: 中等查看答案及解析
-
问题提出:小王同学有次实验时把SO2通入装有BaCl2、FeCl3的混合溶液的试管中,出现了白色浑浊物.
假设、验证:
请把上表填充完全.假设 实验验证方法及现象 假设1 白色浑浊物是BaSO3. (1)______
假设2(2)白色浑浊物是BaSO4,主要
原因是______
.反应开始前,先向制取SO2的装置中通入纯净的CO2,再把产生的SO2通入BaCl2溶液中,不出现浑浊.滴加FeCl3溶液后出现浑浊
(3)通入纯净的CO2的目的______
(4)写出SO2通入BaCl2、FeCl3的混合溶液生成沉淀相关的离子方程式.______.难度: 中等查看答案及解析
-
近年来的许多研究证实,有机硝酸类药(如硝酸甘油)治疗心绞痛、心肌梗塞等心血管疾病,这类药的机理,它在体内转化过程中可产生NO,通过NO的作用,导致平滑肌松弛,血管舒张,血流量增加,使心肌性供血状况改善,病情得以缓解.
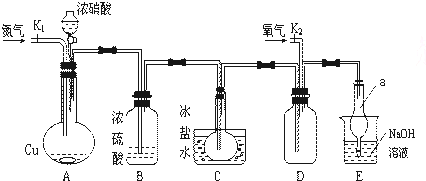
图为某实验者设计的验证铜与浓硝酸反应,生成的NO2气体中含有NO的实验装置图.
已知:常温时,NO2与N2O4混合存在;在低于0℃时,几乎只有无色N2O4晶体存在.
(1)反应前先打开A部分的活塞k1,持续通一段时间N2,其理由是______;
(2)若装置中缺B部分,其后果是______;
(3)反应结束后,打开D部分的活塞k2,并通入氧气,D瓶内气体由无色变为红棕色;若通入的是热氧气,则瓶内气体的颜色比以前更深,其原因______;
(4)C部分装置的作用是______;E部分中a仪器所起的作用是______.难度: 中等查看答案及解析