-
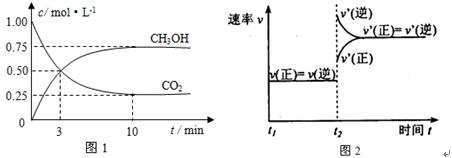
下列关于反应速率和反应平衡的说法中,错误的是
A.反应速率用于衡量化学反应的快慢
B.决定反应速率的主要因素是反应物的性质
C.可逆反应达到化学平衡时,正、逆反应速率都为0
D.增大反应物浓度,提高反应物的温度都能增大反应速率
难度: 中等查看答案及解析
-
下图各为元素周期表的一部分(数字为原子序数),其中X为35的是( )
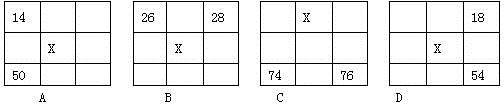
难度: 中等查看答案及解析
-
下列结论正确的是( )
①粒子半径:S2->Cl>S
②氢化物稳定性:HF>HCl>PH3;
③离子还原性:S2->Cl->Br->I-
④单质氧化性:Cl2>S;
⑤酸性:H2SO4>HClO4
⑥碱性强弱:KOH>NaOH>Mg(OH)2
A. ① B. ③⑥ C. ②④⑥ D. ①③④
难度: 中等查看答案及解析
-
可以用来鉴别乙烷和乙烯,还可以用来除去乙烷中乙烯的操作方法是
A.将混合气体通过盛有水的洗气瓶
B.将混合气体通过盛有足量溴水的洗气瓶
C.将混合气体通过盛有硫酸的洗气瓶
D.将混合气体通过盛有澄清石灰水的洗气瓶
难度: 中等查看答案及解析
-
一般地,同一主族的元素最外层电子数相同,其单质及其化合物具有相似的化学性质,下列关于同主族元素所形成物质的性质的推理中,正确的是
A. 钠与氯气反应能形成离子键,故钾与氯气反应也能形成离子键
B. 氯气能置换出NaBr溶液中的溴,故F2能置换出NaCl溶液中的氯
C. Li在氧气中燃烧生成Li2O,故Na在氧气中燃烧生成Na2O
D. C在自然界有稳定的单质存在,故Si在自然界也有稳定的单质存在
难度: 中等查看答案及解析
-
制备硅单质时,主要化学反应如下:
①SiO2 + 2C
Si + 2CO↑
② Si + 2Cl2
SiCl4
③SiCl4 + 2H2
Si + 4HCl
下列对上述三个反应的叙述中,不正确的是
A.①③为置换反应
B.①②③均为氧化还原反应
C.②为化合反应
D.三个反应的反应物中硅元素均被还原
难度: 中等查看答案及解析
-
在无色透明的溶液中可以大量共存的离子组是
A.H+ 、K+ 、Fe2+ 、NO3-
B.OH-、Cl-、Na+、NH4+
C.Cu2+、NO3-、OH-、Cl-
D.Mg2+、K+ 、Cl-、NO3-
难度: 中等查看答案及解析
-
难溶于水而且比水轻的含氧有机物是
①硝基苯 ②苯 ③溴苯 ④植物油 ⑤乙醇 ⑥乙酸乙酯 ⑦乙酸
A. ②④⑥⑦ B. ①②③④⑤ C. ④⑥ D. ①②③
难度: 简单查看答案及解析
-
下列关于能量转换的认识中不正确的是
A.电解水生成氢气和氧气时,电能转化为化学能
B.白炽灯工作时,电能全部转化为光能
C.煤燃烧时,化学能主要转化为热能
D.绿色植物进行光合作用时,太阳能转化为化学能
难度: 中等查看答案及解析
-
下列各组物质中,互为同分异构体的是
A.白磷和红磷
B.CH3CH2CH3和CH3CH2CH2CH3
C.CH3CH(CH3)CH2CH3和CH3CH2CH(CH3)CH3
D.CH3CH(CH3)CH2CH3和CH3CH2CH2CH2CH3
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A.Fe(NO3)2溶液中滴入一定量盐酸:3Fe2++4H++NO3-=2H2O+NO↑+3Fe3+
B.向氯化铵的溶液中加入足量浓NaOH溶液并加热:NH4++OH-
NH3·H2O
C.Ba(OH)2溶液与H2SO4溶液混合产生沉淀:Ba2++ SO42-=BaSO4↓
D.往NaOH溶液中通入过量SO2:SO2+2OH-=SO32- +H2O
难度: 困难查看答案及解析
-
可逆反应2A(g)+3B(g)
2C(g)+D(g)在四种不同条件下的反应速率分别为:
①v(A)=0.5 mol·L-1·s-1;
②v(B)=0.6 mol·L-1·s-1;
③v(C)=0.35 mol·L-1·s-1;
④v(D)=0.4 mol·L-1·s-1,
则该反应在不同条件下反应速率最快的是
A.① B.② C.③ D.④
难度: 中等查看答案及解析
-
下列反应中,属于氧化还原反应同时又是吸热反应的是
A.Ba(OH)2·8H2O与NH4Cl反应
B.铝与盐酸反应
C.灼热的炭与CO2反应
D.甲烷与O2的燃烧反应
难度: 中等查看答案及解析
-
下列装置可以组成原电池的是

难度: 中等查看答案及解析
-
下列排列顺序正确的是
A. 离子半径:Al3+>Mg2+>F-
B. 热稳定性:HI>HBr>HCl>HF
C. 酸性:H2SiO3<H3PO4<H2SO4<HClO4
D. 碱性:Al(OH)3>Mg(OH)2>NaOH
难度: 中等查看答案及解析
-
向50mL 18mol/L的H2SO4溶液中加入足量的铜片并加热,充分反应后,
转移电子的物质的量为( )
A.大于1.80 mol
B.等于0.90 mol
C.在0.90 mol和1.80 mol之间
D.小于0.90 mol
难度: 中等查看答案及解析