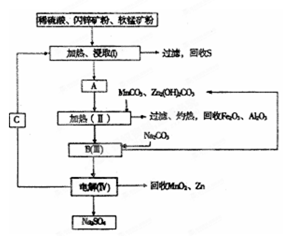
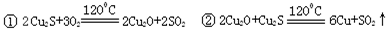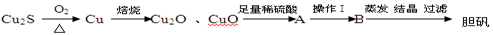-
化学在生产和生活中有着重要的应用。下列说法正确的是( )
A.“雾霾天气”、“温室效应”、“光化学烟雾”的形成都与氮氧化物无关
B.“辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料
C.白酒中混有少量塑化剂,少量饮用对人体无害,可通过过滤方法除去
D.能够改善食品的色、香、味,并有防腐、保鲜作用的食品添加剂,须限量使用
难度: 中等查看答案及解析
-
下列有关实验操作正确的是( )
A.用固体氯化铵和氢氧化钙制氨气结束后,将大试管从铁架台上取下立即进行洗涤
B.用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出
C.做金属钠的性质实验时,剩余的钠放回原试剂瓶
D.向沸腾的NaOH稀溶液中滴入FeCl3饱和溶液,来制备Fe(OH)3胶体
难度: 中等查看答案及解析
-
将足量NO2通入下列各溶液中,所含离子还能大量共存的是( )
A.Fe2+、CH3COO-、Na+、SO42- B.K+、Ca2+、HCO3-、Cl-
C.Al3+、NH4+、Cl-、NO3- D.K+、Na+、SiO32-、AlO2-
难度: 中等查看答案及解析
-
取少量无机盐溶液试样对其中的离子进行检验。下列判断正确的是( )
A.加入盐酸,产生白色沉淀,则试样中一定有Ag+
B.加入盐酸,产生能使澄清石灰水变浑浊的无色气体,则试样中一定有CO32-或HCO3-
C.加入NaOH溶液微热,产生使湿润红色石蕊试纸变蓝气体,则试样中一定有NH4+
D.加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,则试样中一定有SO42-
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的数值,下列叙述正确的是( )
①常温常压下,17g甲基(-14CH3)所含中子数为8NA
②常温下,1L0.1 mol·L-1 Na2CO3溶液中阴离子数目之和大于0.1 NA
③常温常压下,0.3molCl2通入水中,充分反应后转移电子数目为0.3 NA
④250C,pH=13的NaOH溶液中含有OH-数目为0.1 NA
⑤标准状况下,22.4LSO3 的分子数为NA
⑥标准状况下,22.4LNO和11.2L O2混合后气体的分子总数小于NA
A.①②③ B.①②⑥ C.②④⑥ D.③④⑤
难度: 困难查看答案及解析
-
能正确表示下列反应的离子方程式的是( )
A.浓烧碱溶液中加入铝片:Al+2OH-=AlO2-+ H2↑
B.少量钠投入CuSO4溶液中:2Na+Cu2++2H2O=2 Na++Cu(OH)2↓+H2↑
C.碳酸钙与盐酸反应:CO32-+2H+= H2O+CO2↑
D.稀硫酸中加入铁粉:2Fe+6H+=2Fe3++3H2↑
难度: 中等查看答案及解析
-
某同学设计在KOH溶液中用铂作电极,利用CH3OH和O2的反应来构成原电池。下列说法正确的是( ):①正极上O2得到电子,发生还原反应②每消耗1molCH3OH可以向外电路提供6mole-③该电池的总反应为:2CH3OH+3O2=2CO2+4H2O④电池放电后,溶液的pH不断升高
A.①② B.①③ C.②③ D.③④
难度: 中等查看答案及解析
-
下表所列各组物质中,物质之间通过一步反应不能实现如图所示转化的是( )
选项 a b c
A Fe FeCl3 FeCl2
B HNO3 NO NO2
C Al(OH)3 NaAlO2 Al2O3
D NaOH NaHCO3 Na2CO3
难度: 中等查看答案及解析
-
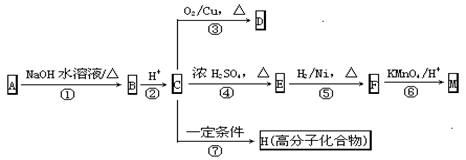
与CH2=CH2→CH2BrCH2Br的变化属于同一反应类型的是( )
A.CH3CHO→C2H5OH B.C2H5OH→CH2=CH2
难度: 中等查看答案及解析
-
分析下表中各项的排布规律,有机物X是按此规律排布的第19项,下列有关X的组成、性质的说法中肯定错误的是( )
1
2
3
4
5
6
7
8
CH4
CH2O
CH2O2
CH4O
C2H6
C2H4O
C2H4O2
C2H6O
①是戊酸②是戊醇③是丁酸甲酯④在稀硫酸中易变质⑤一定能与钠反应
A.②⑤ B.①③④ C.③④ D.②③⑤
难度: 中等查看答案及解析
-
下列选项中,有关实验操作、现象和结论都正确的是( )
选项 实验操作 现象 结论
A 将过量的CO2通入CaCl2溶液中 无白色沉淀出现 生成的Ca(HCO3)2可溶于水
B 常温下将Al片插入浓硫酸中 无明显现象 Al片和浓硫酸不反应
C 向饱和Na2CO3溶液中通入足量CO2 溶液变浑浊 析出了NaHCO3
D 将SO2通入溴水中 溶液褪色 SO2具有漂白性
难度: 中等查看答案及解析
-
下列实验不能达到目的的是( )
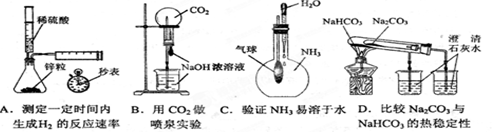
难度: 中等查看答案及解析
-
下列关于电解质溶液的叙述正确的是( )
A.在0.1 mol·L-1 NaHCO3溶液中:c(OH-)+ c(CO32-)=c(H+)+ c(H2CO3)
B.250C时,pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合后pH=7
C.在纯水中加入少量硫酸或硫酸铵,均可抑制水的电离
D.将氨水和盐酸混合后,所得溶液中可能存在:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
难度: 中等查看答案及解析
-
X、Y、Z、W、M五种元素的原子序数依次增大,且X、Y、Z、W均为短周期中的非金属元素,X元素的原子形成的阴离子核外排布与氦原子相同,Z、W在周期表中处于相邻位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍,M是地壳中含量最高的金属元素。下列说法正确的是( )
A.五种元素的原子半径从大到小的顺序是:M> W> Z>Y>X
B.化合物X2W2、YW2、ZW2都含有极性共价键和非极性共价键
C.工业上通常用电解熔融的MCl3来冶炼金属M
D.Z、X两元素能形成原子个数比为1∶3和2∶4的化合物
难度: 困难查看答案及解析
-
以铜为电极,amol/L的硫酸铜溶液作电解液,对含有铁、锌、银的粗铜进行电解精炼,下列有关说法正确的是( ):①粗铜应与电源的负极相连②当有1mol精铜析出时,就有2mol电子通过电解质溶液③阴极上的反应只有Cu2++2e-=Cu④电解结束时,c(CuSO4)<amol/L⑤杂质银以Ag2SO4的形式沉入电解池中
A.②③ B.③④ C.①②④⑤ D.①③⑤
难度: 中等查看答案及解析
-
已知一定温度下,有下列难溶电解质的相关数据:
物质
Fe(OH)2
Cu(OH)2
Fe(OH)3
KSP/250C
8.0×10-16
2.2×10-20
4.0×10-38
完全沉淀时的pH范围
≥9.6
≥6.4
3~4
对含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液的说法,不正确的是( )
A.向该混合溶液中加过量铁粉,能观察到红色固体析出
B.向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀
C.该混合溶液中c(SO42-):[c(Cu2+)+ c(Fe2+)+ c(Fe3+)]>5∶4
D.向该混合溶液中加入适量氯水,并调pH至3~4后过滤,能得到纯净的CuSO4溶液
难度: 中等查看答案及解析
-
在bLFeBr2溶液中通入amolCl2时,使溶液中50%的Br-氧化为Br2,则原FeBr2的物质的量浓度为( )
A.
mol·L-1 B.
mol·L-1 C.
mol·L-1 D.
mol·L-1
难度: 中等查看答案及解析
-
X、M都是中学教材常见元素,下列对两个离子反应通式的推断中,其中正确的是( )
甲:XO3n-+X n-+H+→X单质+H2O(未配平) 乙:Mm++mOH-=M(OH)m↓
①若n=1,则XO3n-中X元素为+5价,X位于周期表第ⅤA族
②若n=2,则X最高价氧化物的水化物可能与它的氢化物反应
③若m=1,则M(NO3)m溶液和氨水互滴时的现象可能不同
④若m=2,则在空气中蒸干、灼烧MSO4溶液一定能得到MSO4
⑤若m=3,则MCl3与足量氢氧化钠溶液反应一定生成M(OH)m
A.①③ B.④⑤ C.①② D.②③
难度: 中等查看答案及解析
-
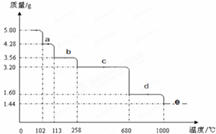
某固体混合物是由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3中的两种或几种组成,现对该混合物做如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):下列说法中不正确的是( )
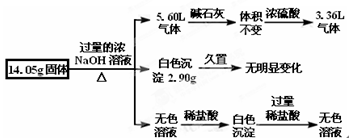
A.该固体中一定没有FeCl2,可能含有AlCl3
B.该固体中含有2.70 g Al
C.该固体中含有6.60 g (NH4)2SO4
D.该固体中含有4.75 g MgCl2
难度: 中等查看答案及解析
-
某稀溶液中含4molKNO3和2.5molH2SO4,向其中加入1.5molFe粉,充分反应后产生的NO气体在标准状况下的体积为( )
A.36L B.28L C.22.4L D.11.2L
难度: 中等查看答案及解析