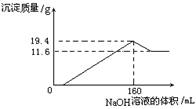
-
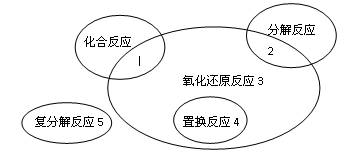
氧化还原反应与四种基本类型反应的关系如右图所示,
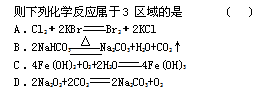
难度: 简单查看答案及解析
-
下列物质中不含有硅酸盐的是 ( )
A.水玻璃 B.硅芯片 C.黏土 D.普通水泥
难度: 简单查看答案及解析
-
下列物质不能与镁反应的是 ( )
A.Cl2 B.N2 C.CO2 D.Ar
难度: 简单查看答案及解析
-
常温下不能与铝反应的物质是 ( )
A.硫酸铜溶液 B.烧碱溶液 C.四氧化三铁 D.稀盐酸
难度: 简单查看答案及解析
-
铝不易被腐蚀,其主要原因是因为铝 ( )
A.是一种轻金属 B.金属活动性比镁弱
C.具有高熔点 D.易形成致密的氧化物薄膜
难度: 简单查看答案及解析
-
实验室用Al2(SO4)3制取Al(OH)3,最合适的试剂是 ( )
A.NaOH B.H2SO4 C.NH3•H2O D.KOH
难度: 简单查看答案及解析
-
下列说法不正确的是 ( )
A.赤铁矿的主要成分是Fe2O3
B.磁铁矿的主要成分是Fe3O4
C.把铁矿石冶炼成铁的过程中,所需原料有铁矿石、焦炭、空气、石灰石等
D.把铁矿石冶炼成铁的过程中,还原剂主要是焦炭
难度: 简单查看答案及解析
-
工业上制石英玻璃和光导纤维的重要原料是 ( )
A.Al2O3 B.MgO C.SiO2 D.Si
难度: 简单查看答案及解析
-
有三组溶液:①汽油和氯化钠溶液 ②四氯化碳(沸点为76.75°C)和甲苯(沸点为110.6°C)溶液 ⑧氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次为 ( )
A.分液、萃取、蒸馏 B.萃取、蒸馏、分液
C.分液、蒸馏、萃取 D.蒸馏、萃取、分液
难度: 简单查看答案及解析
-
检验HCl气体中是否混有Cl2,可采用的方法是 ( )
A.用干燥的蓝色石蕊试纸 B.用干燥的有色布条
C.将气体通入AgNO3溶液中 D.用湿润的淀粉碘化钾试纸
难度: 简单查看答案及解析
-
标准状况下,下列物质的体积最大的是 ( )
A.3g H2 B.64g O2 C.72g H2O D.71g Cl2
难度: 简单查看答案及解析
-
在标准状况下密度为1.25 g/L的是 ( )
A.H2 B.N2 C.O2 D.Cl2
难度: 简单查看答案及解析
-
黑火药是我国历史上的四大发明之一,它的成分是硝酸钾、炭粉和硫粉的混合物,点火爆炸后的产物是二氧化碳、硫化钾和氮气。在该反应中被还原的元素为 ( )
A.S B.C C.N D.S和N
难度: 简单查看答案及解析
-
0.1mol某元素的单质直接与足量氯气反应,质量增加7.1g,这种元素可能是
( )
A.Na B.Al C.Fe D.Cu
难度: 简单查看答案及解析
-
下列关于氯水的叙述不正确的是 ( )
A.氯水滴加到AgNO3溶液中会产生白色沉淀
B.氯水通常应在阴凉处置于棕色细口瓶中密封保存
C.新制氯水可使蓝色石蕊试纸先变红后褪色
D.新制氯水放置数天后溶液的酸性减弱
难度: 简单查看答案及解析
-
下列说法正确的是 ( )
A.为检验某Na2SO3溶液中是否有部分变质成Na2SO4,可选用氯化钡溶液。
B.为鉴别某气体是CO2还是SO2,可选用澄清石灰水。
C.为鉴别某溶液是Na2CO3溶液还是NaHCO3溶液,可选用澄清石灰水。
D.为鉴别某溶液是MgCl2还是AlCl3,可选用NaOH溶液。
难度: 简单查看答案及解析
-
向Na2CO3溶液中逐滴加入稀盐酸,直到不再生成CO2气体为止。在此过程中,HCO3—离子浓度变化趋势是 ( )
A.逐渐变小 B.逐渐增大
C.先增大后减少 D.先减少后增大
难度: 简单查看答案及解析
-
由海水制备无水氯化镁,主要有以下步骤:①在一定条件下脱水干燥;②加熟石灰;③加盐酸;④过滤;⑤浓缩结晶。其先后顺序正确的是 ( )
A.②④⑤③① B.③②④①⑤ C.③④②⑤① D.②④③⑤①
难度: 简单查看答案及解析
-
把aL含硫酸铵和硝酸铵的混合液分成两等份,一份需用b mol烧碱刚好把氨全部赶出,另一份与氯化钡溶液反应时,消耗c mol氯化钡,由此可知原溶液中N03—的物质的量浓度是(单位mol·L—1) ( )
难度: 简单查看答案及解析
-
下列金属中,有一种物质与其它物质的冶炼方法不同,它是 ( )
A.Na B.Mg C.Al D.Fe
【题文】下列除杂所选用的试剂及操作方法不正确的一组是 ( )
选项
待提纯的物质
选用的试剂
操作方法
A
NaBr溶液(NaI)
溴水
萃取分液
B
SiO2固体(CaCO3)
盐酸
过滤
C
FeCl2溶液(FeCl3)
铁粉
过滤
D
CO2气体(HCl)
Na2CO3溶液
洗气
难度: 简单查看答案及解析
-
工业上利用二氧化硅来制取高纯度的硅(硅含量达99.9%以上),反应过程中不需要用到的反应物是 ( )
A.C B.H2 C.CO D.Cl2
难度: 简单查看答案及解析
-
将1molNa和1molAl的混合物投入足量水中,产生气体在标准状况下的体积为 ( )
A.11.2L B.22.4L C.33.6L D.44.8L
难度: 简单查看答案及解析
-
下列物质中①Al ②Al2O3③Al(OH)3④NaHCO3⑤NaHSO4⑥(NH4)2CO3,既能跟强酸溶液反应又能跟强碱溶液反应的有 ( )
A.3种 B.4种 C.5种 D.6种
难度: 简单查看答案及解析
-
在无色透明的酸性溶液中,能大量共存的一组离子是 ( )
A. K+、Na+、SiO32-、Br- B. Na+、K+、ClO-、NO3-
C. K+、Cl-、Fe3+、SO42- D. Mg2+、Na+、Cl-、NO3-
难度: 简单查看答案及解析
-
下列离子方程式的书写正确的是 ( )
A.NaHCO3溶液与NaOH溶液反应: OH- + HCO3- = CO2↑ + H2O
B.向AlCl3溶液中加入过量的氨水:Al3+ + 3OH- = Al(OH)3↓
C.实验室用大理石和稀醋酸制取CO2:CaCO3 +2H+ =Ca 2+ + CO2↑+ H2O
D.Cl2和澄清石灰水反应:Cl2+ 2OH-= Cl- + ClO- + H2O
难度: 简单查看答案及解析
-
下列化合物①Fe3O4 ②AlCl3 ③FeCl2 ④FeCl3 ⑤NaHCO3 ⑥H2SiO3,其中不能通过化合反应制取的有 ( )
A.1种 B.2种 C.3种 D.4种
难度: 简单查看答案及解析
-
有一种铁的“氧化物”样品,用5mol/L盐酸200mL恰好完全溶解,所得溶液还能吸收标况下2.24L氯气,恰好使其中Fe2+全部转化成Fe3+,该样品可能的化学式是 ( )
A.Fe2O3 B.Fe3O4 C.Fe4O5 D.Fe5O7
难度: 简单查看答案及解析
-
现有五种离子化合物A、B、C、D和E,都是由下表中的离子形成的:
阳离子
Ag+
Ba2+
Al3+
阴离子
OH-
Cl-
SO42 -
为鉴别它们,分别完成以下实验,其结果是:
①B和D都不溶于水,也不溶于酸;
②A溶于水后,与上述某阳离子反应可生成B,且A溶液与过量的氨水反应生成白色沉淀;
③C溶于水后,与上述某阳离子反应可生成D,且C溶液与过量的氨水过量反应生成白色沉淀;
④E溶于水后,与上述某阴离子反应可生成B;
⑤A溶液与适量E溶液反应生成沉淀,再加入过量E溶液,沉淀量减少,但不消失。
请根据上述实验结果,写出下列物质的化学式:
A__________,B________,C_________,D__________,E__________。
难度: 简单查看答案及解析