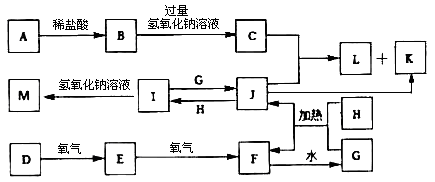
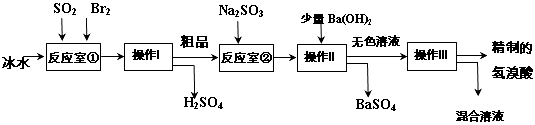
-
“雾霾”可造成空气污染,空气是人类生存所必需的重要资源。为改善空气质量而启动的“蓝天工程”得到了全民的支持。下列措施中,不利于“蓝天工程”建设的是
A.推广使用燃煤脱硫技术,防治SO2污染
B.实施绿化工程,防治扬尘污染
C.研制开发燃料电池汽车,消除机动车尾气污染
D.加大石油、煤炭的开采速度,增加化石燃料的使用量
难度: 简单查看答案及解析
-
材料与化学密切相关。下列物质与用途对应关系不正确的是
A.碘化钾——加碘盐 B.氧化铝——耐火材料
C.铁碳合金——碳素钢 D.硅酸盐——普通玻璃
难度: 简单查看答案及解析
-
下列生活小常识或家庭小实验中不涉及化学变化的是
A.用食醋去除水垢
B.用竹炭包可清楚衣柜内的异味
C.用铁钉等材料探究铁生锈的条件
D.用柠檬汁涂抹在切开苹果表面可防止苹果变色
难度: 简单查看答案及解析
-
下列表格中各项分类都正确的一组是
类别
选项
纯净物
混合物
电解质
非电解质
A
生理盐水
明矾
液态KNO3
蔗糖
B
CaO
海水
铜
乙醇
C
胆矾
铝合金
AgCl
CO2
D
氢氧化钠
空气
Na2SO4溶液
食醋
难度: 中等查看答案及解析
-
下列实验操作中不正确的是
A.配制240mL溶液需要用到250mL容量瓶
B.用四氯化碳萃取碘水中的碘
C.用过滤的方法分离胶体和溶液
D.蒸馏时应将温度计水银球放在与蒸馏烧瓶的支管口相平处
难度: 简单查看答案及解析
-
下列应用不涉及氧化还原反应的是
A.Na2O2用作呼吸面具的供氧剂
B.实验室用NH4Cl和Ca(OH)2制备氨气
C.工业上利用合成氨实现人工固氮
D.工业上用电解熔融状态的Al2O3制备Al
难度: 中等查看答案及解析
-
下列有关试剂的保存方法错误的是
A.氢氧化钠溶液保存在具有橡皮塞的玻璃试剂瓶中
B.少量的钠保存在煤油中
C.氢氟酸盛装在细口玻璃瓶中
D.新制的氯水通常保存在棕色玻璃试剂瓶中
难度: 中等查看答案及解析
-
在实验室中,对下列事故或药品的处理正确的是
A.有大量的氯气泄漏时,用肥皂水浸湿软布蒙面,并迅速离开现场
B.金属钠着火燃烧时,用泡沫灭火器灭火
C.铝质餐具可代替铁质餐具长时间存放酸性、碱性食物
D.在50mL量筒中配制0.1mol/L碳酸钠溶液
难度: 中等查看答案及解析
-
化学与环境密切相关,下列说法正确的是
A.Na2O2属于碱性氧化物
B.酸雨是pH小于7的雨水
C.CO2、NO2或SO2都会导致酸雨的形成
D.大雾是一种胶体,能发生丁达尔效应
难度: 简单查看答案及解析
-
判断下列有关化学基本概念的依据正确的是
A.氧化还原反应:元素化合价是否变化
B.纯净物与混合物:是否仅含有一种元素
C.强弱电解质:溶液的导电能力大小
D.溶液与胶体:本质不同的原因是能否发生丁达尔效应
难度: 中等查看答案及解析
-
下列各项操作中,“先沉淀后溶解”现象的是
A.向CaCl2溶液中通入过量SO2
B.向Na2SiO3溶液中滴入过量的盐酸
C.向饱和的Na2CO3溶液中通入过量CO2
D.向Al2(SO4)3溶液中滴入过量的NaOH溶液
难度: 中等查看答案及解析
-
化学与科学、技术、社会、环境密切相关。下列有关说法中错误的是
A.燃放的焰火是某些金属元素焰色反应所呈现出来的色彩
B.小苏打是制作馒头和面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂
C.为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅胶
D.可用漂白粉和漂白液对地震后的受灾地区进行杀菌消毒
难度: 简单查看答案及解析
-
如图所示的实验或操作中,能达到实验目的的是
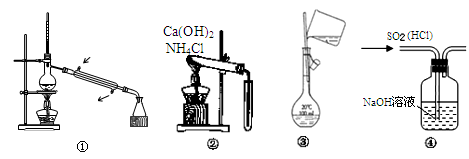
A.图①常用于分离沸点不同且彼此互溶的液态混合物
B.图②可用于实验室制备并收集少量的NH 3
C.图③表示的是实验室配制溶液转移过程
D.图④可用于除去SO 2 中的HCl气体
难度: 中等查看答案及解析
-
下列有关金属的性质及应用正确的是
A.Na放置在空气中生成淡黄色的Na2O2固体
B.Fe在O2中燃烧产物可用于制红色涂料
C.Na、Al、Cu可以分别用电解冶炼法、热还原法和热分解法得到
D.FeCl2溶液中滴加氨水至过量,加热蒸干溶液,最后灼烧可得到Fe2O3固体
难度: 中等查看答案及解析
-
下列关于Na2CO3和NaHCO3的说法中,不正确的是
A.Na2CO3和NaHCO3均可与HCl反应
B.Na2CO3能与石灰水反应而NaHCO3不能
C.Na2CO3的热稳定性比NaHCO3的强
D.Na2CO3比NaHCO3易溶于水
难度: 中等查看答案及解析
-
在溶液中能共存,加入OH-有沉淀析出,加入H+能放出气体的是
A.Na+、 H+、NO3-、Clˉ
B.K+、 H+、 Clˉ、 SO42ˉ
C.Ca2+、 NO3-、 HCO3ˉ、Cl-
D.Fe3+、NH4+、SCN-、Clˉ
难度: 中等查看答案及解析
-
下列陈述I、II正确并且有因果关系的是
选项
陈述I
陈述II
A
SO2有漂白性
SO2可使KMnO4溶液褪色
B
Si有导电性
Si可用于制备光导纤维
C
浓硫酸有强氧化性
浓硫酸可用于干燥H2和CO
D
Fe3+有氧化性
FeCl3溶液可用于回收废旧电路板中的铜
难度: 中等查看答案及解析
-
向Fe2O3、CuO、Fe、Cu的混合粉末中加入过量的稀盐酸,充分反应后,仍有红色粉末存在,则关于溶液中阳离子的判断正确的是
A.一定有Fe2+,可能有Cu2+ B.只有Fe2+和Cu2+
C.一定有Fe2+、Cu2+,可能有Fe3+ D.只有Fe2+
难度: 中等查看答案及解析
-
下列实验现象,与新制氯水中的某些成分(括号内物质)没有关系的
A.将NaHCO3固体加入新制氯水,有无色气泡(H+)
B.滴加AgNO3溶液生成白色沉淀(Cl-)
C.向KI溶液中滴加氯水,再滴加CCl4溶液,发现CCl4溶液呈紫色(Cl2)
D.使红色布条褪色(HCl)
难度: 中等查看答案及解析
-
对于下列事实的解释错误的是
A.在蔗糖中加入浓H2SO4后出现发黑现象,说明浓硫酸具有脱水性
B.常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应
C.浓硝酸在光照下颜色变黄,说明浓硝酸不稳定
D.氨水可使酚酞试剂变为红色,说明氨水显碱性
难度: 中等查看答案及解析
-
下列有关离子检验的操作和实验结论正确的是
A.向某溶液加入NaOH并微热,产生能够使湿润的红色石蕊试纸变蓝的无色气体,该溶液中一定含有NH4+
B.向某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成,该溶液中一定含有SO42-
C.向某溶液中加入氨水,产生白色沉淀,则该溶液中一定含有Mg2+
D.用铂丝蘸取某溶液在酒精灯火焰上灼烧,若火焰呈黄色,则证明该溶液中无K+离子
难度: 中等查看答案及解析
-
下列离子方程式书写正确的
A.钠与水的反应:Na +2H2O=Na+ + 2OH- +H2↑
B.硅酸钠溶液中通入过量CO2:SiO32-+2CO2+ 2H2O=H2SiO3↓+2HCO3-
C.氯气与水反应:Cl2+H2O=2H++Cl-+ClO-
D.明矾溶液中加入过量的Ba(OH)2溶液:Al3+ + 4OH- ==AlO2- +2H2O
难度: 中等查看答案及解析
-
宋代著名法医学家宋慈的《洗冤集录》中有---银针验毒的记载,“银针验毒”的原理是4Ag+2H2S+O2=2X+2H2O,下列说法不正确的是
A.X的化学式为Ag2S
B.银针验毒时,空气中氧气得到电子
C.反应中Ag和H2S均是还原剂
D.每生成1molX,反应转移2mole-
难度: 中等查看答案及解析
-
若NA表示阿伏加德罗常数,下列说法正确的是
A.在标准状况下,NA个水分子所占的体积约为22.4L
B.5.6g铁与氯气完全反应,失去的电子数为0.2NA
C.1molCl2发生化学反应,转移的电子数必为2NA
D.在标准状况下,22.4L由N2、N2O组成的混合气体中所含氮原子物质的量为2mol
难度: 困难查看答案及解析
-
在某溶液中含MgCl2和AlCl3各0.01mol,向其中逐滴加入1mol/L的NaOH溶液至过量,下列关系图正确的是
A.
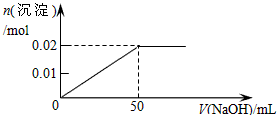 B.
B.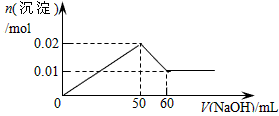
C.
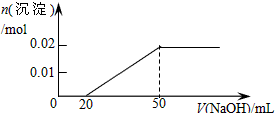 D.
D.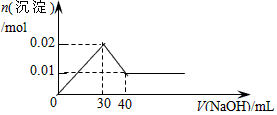
难度: 困难查看答案及解析