-
某化学实验小组的同学为了探究SO2和氯水的漂白性,设计如下实验装置。

(1)写出A中反应的化学方程式__________,浓硫酸表现出__________性。
(2)实验室用装置E制备Cl2,离子方程式为:_____________该反应中的还原剂是_________(填化学式)。
(3)①装置A和E中,常用于萃取操作的仪器是__________(填名称)
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为B:__________,D:__________.
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强.他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现品红溶液未褪色,并且生成了两种常见的强酸,请你分析该现象的原因:__________________(用化学方程式表示)。
(5)第三个实验小组同学查阅资料得知:氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗品及精制的流程:
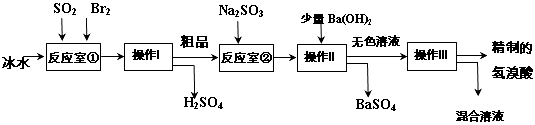
已知:Br 2 是易挥发、深红棕色的液体,与Cl2化学性质相似;氢溴酸是易挥发、无色液体。
根据上述流程回答下列问题:
①反应室①使用冰水的目的 。
②操作I的名称 ,操作Ⅱ的名称 。
③反应室②中加入Na2SO3的目的是 。
④工业生产中制得的氢溴酸带有淡黄色。于是甲乙两同学设计了实验加以探究:
A.甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+ ,则用于证明该假设所用的试剂为 ,若假设成立可观察到的现象为 。
B.乙同学假设工业氢溴酸呈淡黄色是因为 ,其用于证明该假设成立的方法为 。
-
某化学实验小组的同学为了探究SO2和氯水的漂白性,设计了如图所示实验装置。

(1)写出A中反应的化学方程式:___________, 浓硫酸表现出_____性。
(2)实验室用装置E制备Cl2,离子方程式为____________。该反应中的还原剂是_______(填化学式)。
(3)①装置A和E中,常用于萃取操作的仪器是__________(填名称)。
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为B.______,D._____。
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1:1同时通入品红溶液中,结果发现品红溶液未褪色,并且生成了两种常见的强酸,请你分析该现象的原因:__________(用化学方程式表示)。
-
某化学实验小组的同学为了探究SO2和氯水的漂白性,设计了如图实验装置。

(1)写出A中反应的化学方程式__________,浓硫酸表现出__________性。
(2)实验室用装置E制备Cl2,离子方程式为_____________________________,生成标准状况下2.24 L气体时需要还原剂_________mol。
(3)①装置A中使用前需检漏的仪器是_________(填名称)。
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为B:_______,D:______________。
-
某化学实验小组的同学为了探究SO2和氯水的漂白性,设计如下实验装置。

(1)C装置的作用:______________________________。
(2)实验室用装置E制备Cl2,化学反应方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。该反应中的还原剂是____________(填化学式)。
MnCl2+Cl2↑+2H2O。该反应中的还原剂是____________(填化学式)。
(3)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:
B_________________________, D________________________。
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为
B_________________________, D________________________。
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后漂白性肯定会增强。他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现品红溶液未退色。请你分析产生该现象的原因_____________________________(用化学方程式表示)。
-
某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
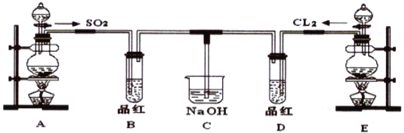
(1)写出Cu与浓硫酸制备SO2的化学方程式__________。
(2)实验室用装置E制备Cl2的离子方程式_________ 。指出该反应中HCl(浓)所表现出的化学性质__________、___________。
(3)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现__________的现象。
A品红都褪色 B品红都不褪色
C试管B 中品红褪色D 中不褪色 D试管D 中品红褪色B 中不褪色
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象又分别为_____。
A 无色 红色 B 无色 无色 C 红色 红色 D 红色 无色
(4)C烧杯氢氧化钠溶液的作用是___________。
(5)另一个实验小组的同学认为SO2 和氯水都有漂白性,二者混合后的漂白性肯定会更强,他们将制得的SO2和Cl2按1∶1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)________。
-
某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如图的实验装置:

(1)实验室用装置A,用浓硫酸和铜反应制备SO2,请写出化学反应方程式____________
(2)反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:B_____、D______,停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为B_____、D______。
(3)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)____________。
-
某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。

小组同学在实验时,当打开A的分液漏斗的下面活塞后,发现漏斗内的液体未流下,其原因可能是 。
配平装置E中反应的化学化学方程式:
MnO2 + HCl(浓) MnCl2 + +
MnCl2 + +
A、E均开始反应,当观察到B、D中的品红溶液均已褪色时,停止反应通气。取下B、D两个试管,分别加热,出现的现象是 。
(4)当小组同学将SO2和Cl2按体积比1:1,同时通入到品红溶液时,观察到品红溶液几乎没有出现褪色现象,分析其原因可能是(用化学用语表示) 。
-
某化学实验小组的同学为探究和比较SO2和Cl2的漂白性,设计了如下的实验装置。

(1)实验室常用软锰矿(主要成分是MnO2)与浓盐酸混合加热的方法制备Cl2,写出实验室制备氯气的化学方程式:________________________________________________。在此化学反应中,氧化剂与还原剂的物质的量之比为____________;若反应过程中转移电子的物质的量为6 mol,则生成氯气的物质的量为____________mol。
(2)反应开始一段时间后, B、D两个试管中的品红溶液出现的现象是: B:_______________________; D:________________________;
(3)停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别是:B:_______________________; D:________________________;
(4)实验中NaOH溶液的作用是________________________________________。若将C中NaOH溶液换成水,当通入物质的量比为1:1的SO2和Cl2,恰好反应生成两种强酸(其中一种是含氧酸,另一种是无氧酸),该反应的化学方程式是:_____________________________________________________________________。
-
某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。请回答下列问题:
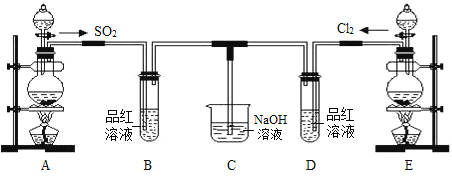
(1)实验室用装置E制备Cl2,其反应的化学方程式为MnO2+4HCl(浓)  MnCl2 + Cl2↑ + 2H2O。将上述化学方程式改写为离子方程式_______________________________。
MnCl2 + Cl2↑ + 2H2O。将上述化学方程式改写为离子方程式_______________________________。
(2)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现__________的现象(填选项序号,下同)。
A.品红溶液都褪色 B.品红溶液都不褪色
C.B中品红溶液褪色,D中不褪色 D.D中品红溶液褪色,B中不褪色
②停止通气后,再给B、D两个试管分别加热,两个试管中的溶液呈现的颜色分别为________。
A.无色、红色 B.无色、无色 C.红色、红色 D.红色、无色
(3)C烧杯中氢氧化钠溶液的作用是_____________________________,写出Cl2通入NaOH溶液中的化学方程式_______________________________。
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强,他们将制得的SO2和Cl2按物质的量之比1︰1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请分析该现象的原因(用离子方程式表示)_______________________________________。
-
(13分)某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
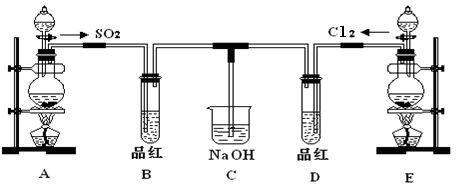
(1)实验室用装置E制备Cl2,其反应的化学化学方程式为:MnO2+4HCl(浓) MnCl2+Cl2 +2H2O请指出该反应中的液体反应物在反应中所表现出的化学性质:
MnCl2+Cl2 +2H2O请指出该反应中的液体反应物在反应中所表现出的化学性质:
____________________________________________________________________;
(2)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:
B:________________________________,D:_________________________。
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为
B:________________________________,D:____________________________。
(3)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强,他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象那样。请你分析该现象的原因(用化学方程式表示)__________________________________










