-
已知X、Y、Z、T、W是短周期中原子序数依次增大的5种主族元素,其中X、T同主族,X与Y形成的简单气态化合物能使湿润的红色石蕊试纸变蓝,Z原子的最外层电子数是电子层数的3倍,W是一种重要的半导体材料。下列说法正确的是
A. 原子半径: X<Y<Z<T
B. Y元素的含氧酸都属于强酸
C. Z、T和W三种元素形成的化合物的水溶液呈碱性
D. 元素Z、T组成的化合物中阴阳离子个数之比为2∶1
难度: 中等查看答案及解析
-
人们对原子结构的认识有一个不断深入的过程,下列先后顺序中符合化学史实的是( )
①道尔顿提出的原子论 ②卢瑟福的原子结构行星模型 ③波尔提出的原子力学模型 ④汤姆生提出的葡萄干面包原子模型 ⑤现代量子力学模型
A. ①②④⑤③ B. ①④②③⑤ C. ②①④⑤③ D. ①③⑤②④
难度: 简单查看答案及解析
-
某元素的原子最外电子层排布是6s26p4,该元素或其化合物不可能具有的性质是 ( )
A. 该元素单质可能是导体 B. 该元素的最高化合价呈+6价
C. 该元素单质能与氢气反应生成气态氢化物 D. 该元素价电子轨道中有2个未成对电子
难度: 中等查看答案及解析
-
下列各组元素都属于p区的是
A. 原子序数为1,6,7的元素 B. Na,Li,Mg
C. Fe,Cu,Cl D. O,S,P
难度: 简单查看答案及解析
-
下列化学用语或物质结构的表述正确的是
A. 中子数为10 的氧原子:
B. 过氧化氢的电子式:H—O—O—H
C. CS2中各原子最外层都满足8 电子结构
D. CH2Cl2是四面体构型的含非极性键的分子
难度: 中等查看答案及解析
-
一定条件下,氨气与氟气发生反应:4NH3+3F2=NF3+3NH4F,其中NF3分子构型与NH3相似。下列有关说法错误的是
A.NF3中只含有极性共价键
B.NF3既是氧化产物,又是还原产物
C.NH4F中既含有离子键又含有共价键
D.上述反应中,反应物和生成物均属于共价化合物
难度: 中等查看答案及解析
-
已知短周期元素的离子aA2+、bB+、cC3-、dD- 都具有相同的核外电子层结构,则下列叙述正确的( )
A. 原子半径 A>B>D>C B. 原子序数:d>c>b>a
C. 离子半径:C>D>B>A D. 单质的还原性:A>B>D>C
难度: 困难查看答案及解析
-
有A、B、C三种主族元素,已知A元素原子的价电子构型为ns1,B元素原子的M层上有两个未成对电子,C元素原子L层的p轨道上有一对成对电子,由这三种元素组成的化合物的化学式不可能是( )
A. A3BC4 B. A2BC4 C. A2BC3 D. A4BC4
难度: 困难查看答案及解析
-
N2的结构可以表示为
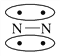 ,CO的结构可以表示为
,CO的结构可以表示为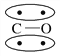 ,其中椭圆框表示π键,下列说法中不正确的是( )
,其中椭圆框表示π键,下列说法中不正确的是( )A. N2分子与CO分子中都含有三键
B. CO分子中有一个π键是配位键
C. N2与CO互为等电子体
D. N2与CO的化学性质相同
难度: 中等查看答案及解析
-
下列各组物质的熔点均与所含化学键的键能有关的是
A. CaO与CO2 B. NaCl与HCl C. SiC与SiO2 D. Cl2与I2
难度: 中等查看答案及解析
-
通常把原子总数和价电子总数相同的分子或离子称为等电子体。人们发现等电子体的空间结构相同,则下列有关说法中正确的是( )
A. CH4和NH4+是等电子体,键角均为60°
B. NO3―和CO32―是等电子体,均为平面正三角形结构
C. H3O+和PCl3是等电子体,均为三角锥形结构
D. B3N3H6和苯是等电子体,B3N3H6分子中不存在“肩并肩”式重叠的轨道
难度: 中等查看答案及解析
-
下列分子的立体构型可用sp2杂化轨道来解释的是( )
①BF3②CH2=CH2③苯 ④CH≡CH ⑤NH3⑥CH4.
A. ①②③ B. ①⑤⑥ C. ②③④ D. ③⑤⑥
难度: 中等查看答案及解析
-
0.01mol氯化铬(CrCl3·6H2O)在水溶液中用过量的AgNO3处理,产生0.02mol AgCl沉淀,此氯化铬最可能是( )
A. [Cr(H2O)6]Cl3 B. [Cr(H2O)5Cl]Cl2·H2O
C. [Cr(H2O)4Cl2]Cl·2H2O D. [Cr(H2O)3Cl3]·3H2O
难度: 中等查看答案及解析
-
己知[Co(NH3)6]3+的立体结构如图,其中1~6处的小圆圈表示NH3分子,且各相邻的NH3分子间的距离相等(图中虚线长度相等)。Co3+位于八面体的中心,若其中两个NH3被Cl-取代,所形成的[Co(NH3)4Cl2]+的结构的数目为( )

A. 1 B. 2 C. 3 D. 4
难度: 中等查看答案及解析
-
氨分子立体构型是三角锥形,而甲烷是正四面体形,这是因为( )
A. 两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化
B. NH3分子中N原子形成3个杂化轨道,CH4分子中C原子形成4个杂化轨道
C. NH3分子中有一对未成键的孤电子对
D. 氨分子是极性分子而甲烷是非极性分子
难度: 中等查看答案及解析
-
用价电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,也可推测键角大小,下列判断正确的是
A. CS2是V形分子 B. SnBr2键角大于120°
C. BF3是三角锥形分子 D. NH4+键角等于109.5°
难度: 中等查看答案及解析
-
通常情况下,NCl3是一种油状液体,其分子空间构型与NH3相似,下列对NCl3和NH3的有关叙述正确的是( )
A. 分子中N—Cl键键长与CCl4分子中C—Cl键键长相等
B. 在氨水中,大部分NH3与H2O以氢键(用“…”表示)结合形成NH3·H2O分子,则NH3·H2O的结构式为:
C. NCl3分子是非极性分子
D. NBr3比NCl3易挥发
难度: 中等查看答案及解析
-
S2Cl2是橙黄色液体,少量泄漏会产生窒息性气体,喷水雾可减慢其挥发,并产生酸性悬浊液。其分子结构如图所示。下列关于S2Cl2的说法中错误的是( )
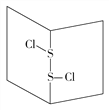
A. S2Cl2为非极性分子
B. 分子中既含有极性键又含有非极性键
C. S2Br2与S2Cl2结构相似,熔、沸点S2Br2>S2Cl2
D. 与水反应的化学方程式可能为2S2Cl2+2H2O===SO2↑+3S↓+4HCl
难度: 困难查看答案及解析
-
下列有关NH4Cl、PH3、C2H4、Na2O2、CaCl2、SiO2的说法正确的是( )
A. 含有配位键的是NH4Cl、PH3、Na2O2 B. 含有非极性键的是C2H4、Na2O2、CaCl2
C. 含有极性键的是NH4Cl、PH3、CaCl2 D. 含有离子键的是NH4Cl、Na2O2、CaCl2
难度: 中等查看答案及解析
-
在“石蜡→液体石蜡→石蜡蒸气→裂化气”的变化过程中,被破坏的作用力依次是 ( )
A. 范德华力、范德华力、范德华力
B. 范德华力、范德华力、共价键
C. 范德华力、共价键、共价键
D. 共价键、共价键、共价键
难度: 中等查看答案及解析
-
碳酸亚乙烯酯是锂离子电池低温电解液的重要添加剂,其结构如图。下列有关该物质的说法正确的是( )
A. 分子式为C3H2O3
B. 分子中含6个σ键
C. 分子中只有极性键
D. 8.6 g该物质完全燃烧得到6.72 L CO2
难度: 中等查看答案及解析
-
如图所示,在较高温度时,钾、氧两元素形成的一种晶体结构与NaCl晶体结构相似,则该化合物的化学式为
A.KO2 B.K2O2 C.K2O3 D.K2O
难度: 中等查看答案及解析
-
据某科学杂志报道,国外有一研究发现了一种新的球形分子,它的分子式为C60Si60,其分子结构好似中国传统工艺品“镂雕”,经测定其中包含C60,也有Si60结构。下列叙述正确的是 ( )
A. 该物质有很高的熔点、很大的硬度 B. 该物质形成的晶体属于分子晶体
C. 该物质分子中Si60被包裹在C60里面 D. 该物质的相对分子质量为1200
难度: 中等查看答案及解析
-
冰晶胞中水分子的空间排列方式与金刚石晶胞类似,如图,下列有关冰晶胞说法正确的是( )
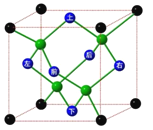
A. 冰晶胞内水分子间以共价键结合
B. 每个冰晶胞平均含有4个水分子
C. 水分子间的氢键具有方向性和饱和性,也是σ键的一种
D. 实验测得冰中氢键的作用力为18.5kJ/mol,而冰的熔化热为5.0kJ/mol,这说明冰熔化成水,氢键部分被破坏
难度: 困难查看答案及解析
-
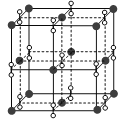
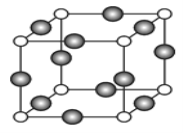
某晶体的一部分如图所示,这种晶体中A、B、C三种粒子数之比是( )

A. 3∶9∶4 B. 1∶4∶2
C. 2∶9∶4 D. 3∶8∶4
难度: 简单查看答案及解析
 。
。