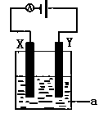
-
下列制作铅笔的材料与相应工业不对应的是
A.橡皮擦——橡胶工业 B.铝合金片——冶金工业
C.铝笔芯—电镀工业 D.铅笔漆—涂料工业
难度: 简单查看答案及解析
-
向某酸性透明溶液中加入新制氯水后,各离子仍可大量共存的是
A.Fe3+、K+、SO42-、NO3- B.K+、Na+、SO32-、Cl-
C.NH4+、K+、SO42-、Br- D.K+、Na+、AlO2— 、NO3—
难度: 简单查看答案及解析
-
下列化学用语使用正确的是
A.中子数为9的氧原子符号为16O
B.某元素的一种原子质量数为X则该元素的相对原子质量为X
C.H、D、T三种核素化学性质不相同
D.次氯酸的结构式:H—O—Cl
难度: 中等查看答案及解析
-
Al、Fe、Cu都是重要而常见的金属,下列有关说法正确的是
A.三者的单质在常温下都能溶于浓硫酸和浓硝酸
B.三者的单质放置在空气中均只生成氧化物
C.三者所对应的氢氧化物在水中都存在溶解平衡
D.工业上制备这三种金属的方法依次为电解法、热分解法和热还原法
难度: 中等查看答案及解析
-
一般情况下,前者无法决定后者的是
A.原子核外电子排布——元素在周期表中的位置
B.弱电解质的相对强弱——电离常数的大小
C.分子间作用力的大小——分子稳定性的高低
D.物质内部储存的能量——化学反应的热效应
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述不正确的是
A.36g镁在足量的氮气中完全燃烧共转移的电子数为3NA
B.标准状况下,44.8LNO与22.4LO2混合后气体中分子总数为2NA
C.室温下,21.0g乙烯和丁烯的混合气体中含有的碳氢共价键数目为3NA
D.1molNa2O和Na2O2混合物中含有的阴、阳离子总数是3NA
难度: 简单查看答案及解析
-
单斜硫和正交硫转化为二氧化硫的能量变化图如图所示。
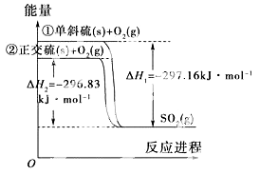
下列说法正确的是
A.S(s,单斜)=S(s,正交) ΔH=+0.33 kJ·mol-1
B.正交硫比单斜硫稳定
C.相同物质的量的正交硫比单斜硫所含有的能量高
D.①式表示断裂1 mol O2中的共价键所吸收的能量比形成1 mol SO2中的共价键所放出的能量少297.16 kJ
难度: 中等查看答案及解析
-
在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是
A.氯水的颜色呈浅黄绿色,说明氯水中含有Cl2
B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl-
C.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+
D.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO
难度: 中等查看答案及解析
-
下列有关性质的比较,不能用元素周期律解释的是
A.酸性:H2SO4>H3PO4 B.非金属性:Cl>Br
C.碱性:NaOH>Mg(OH)2 D.热稳定性:Na2CO3>NaHCO3
难度: 中等查看答案及解析
-
下列说法正确的是
A.为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可
B.做蒸馏实验时,在蒸馏烧瓶中应加入沸石,以防暴沸。如果在沸腾前发现忘记加沸石,应立即停止加热,冷却后补加
C.在未知溶液中滴加BaCl2溶液出现白色沉淀,加稀硝酸,沉淀不溶解,说明该未知溶液中存在SO42-或SO32-
D.提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤、干燥的方法
难度: 中等查看答案及解析
-
甲~庚等元素在元素周期表中的相对位置如下表,己的最高价氧化物对应的水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数,下列判断正确的是
A.丙与戊的原子序数相差28
B.气态氢化物的稳定性:庚<己<戊
C.常温下,甲和乙的单质均能与水剧烈反应
D.丁的最高价氧化物可广泛可于太阳能电池
难度: 中等查看答案及解析
-
关于下列各装置图的叙述不正确的是


A.用图①装置精炼铜,a极为粗铜,电解质溶液为CuSO4溶液
B.图②装置的盐桥中KCl的Cl-移向乙烧杯
C.图③装置中钢闸门可与外接电源的负极相连受到保护
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同
难度: 中等查看答案及解析
-
在不同浓度(c)、温度(T)条件下,蔗糖水解的瞬时速率(v)如下表。下列判断不正确的是
c/mol·L-1
V/mmol·L-1·min-1
T/K
0.600
0.500
0.400
0.300
318.2
3.60
3.00
2.40
1.80
328.2
9.00
7.50
a
4.50
b
2.16
1.80
1.44
1.08
A.a=6.00 B.同时改变反应温度和蔗糖的浓度,v可能不变
C.b<318.2 D.不同温度时,蔗糖浓度减少一半所需的时间相同
难度: 中等查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是:
A.向稀HNO3中滴加Na2SO3溶液:SO32—+2H+=SO2↑+H2O
B.漂白粉溶液中通入足量二氧化硫气体:ClO-+SO2+H2O===HClO+HSO
C.NaHCO3溶液中加少量Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O
D.向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O=4Na++2Cu(OH)2↓+O2↑
难度: 中等查看答案及解析
-
某模拟“人工树叶”电化学实验装置如右图所示,该装置能将H2O和CO2转化 为O2和燃料(C3H8O)。下列说法正确的是
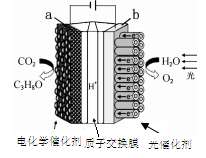
A.该装置将化学能转化为光能和电能
B.该装置工作时,H+从b极区向a极区迁移
C.每生成1molO2,有44gCO2被还原
D.a电极的反应为:3CO2+18H+-18e-=C3H8O+5H2O
难度: 中等查看答案及解析
-
向溶液X中持续通入气体Y,不会产生“浑浊→澄清”现象的是
A.X:硝酸银溶液,Y:氨气 B.X:漂白粉溶液,Y:二氧化硫
C.X:氢氧化钡溶液,Y:二氧化碳 D.X:偏铝酸钠溶液,Y:二氧化氮
难度: 中等查看答案及解析
-
下列有关物质性质或应用的说法正确的是
A.钠的金属性比钾强,工业上用钠制取钾(Na+K
K↑+NaCl)
B.利用Al2O3制作的坩埚,可用于熔融烧碱
C.制水泥和玻璃都用石灰石作原料
D.氢氟酸具有强酸性,用氢氟酸蚀刻玻璃
难度: 中等查看答案及解析
-
在T ℃时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g·cm-3,溶质的质量分数为w,其中含NH4+的物质的量为b mol。下列叙述中一定正确的是
A.溶质的质量分数为w=
×100%
B.溶质的物质的量浓度c=
mol·L-1
C.溶液中c(OH-)=
mol·L-1
D.上述溶液中再加入VmL水后,所得溶液溶质的质量分数大于0.5w
难度: 中等查看答案及解析
-
某无色溶液中可能存在Al3+、H+、Na+、SO32—、CO32—、NO3—、AlO2—和S2—八种离子中的几种,进行如下实验:①向溶液中加入足量的稀盐酸,产生无色气体;②继续滴加BaCl2溶液,产生白色沉淀;③过滤后,向滤液中逐滴加入NaOH溶液,产生白色沉淀;继续滴加,白色沉淀消失。由此推断原溶液
A.一定存在的离子是Na+、SO32—、NO3—、AlO2—
B.一定存在的离子是Na+、SO32—、CO32—、AlO2—
C.可能存在的离子是Al3+、CO32—
D.可能存在的离子是CO32—、S2—
难度: 中等查看答案及解析
-
已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+。现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如右图所示,下列说法中不正确的是
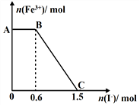
A.图中AB段的氧化剂为K2Cr2O7
B.图中BC段发生的反应为2Fe3++2I—=2Fe2++I2
C.开始加入的K2Cr2O7为0.25mol
D.K2Cr2O7与FeSO4反应的物质的量比为1∶3
难度: 中等查看答案及解析
-
在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。下列说法不正确的是

A.X是电源的负极
B.阴极的反应式是:H2O+2eˉ=H2+O2ˉ CO2+2eˉ=CO+O2ˉ
C.总反应可表示为:H2O+CO2 = H2+CO+O2
D.阴、阳两极生成的气体的物质的量之比是1︰1
难度: 中等查看答案及解析
-
某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质) 制取七水合硫酸亚铁(FeSO4·7H2O) ,设计了如下流程:

下列说法不正确的是
A.溶解烧渣选用足量硫酸,试剂X选用铁粉
B.固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2
C.从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解
D.若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O
难度: 中等查看答案及解析
-
1.52g铜镁合金完全溶解于50 mL密度为1.40g/cm3、质量分数为63%的浓硝酸中,得到NO2和N2O4 的混合气体1120mL (标准状况),向反应后的溶液中加入1.0mol·L-1NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是
A.该合金中铜与镁的物质的量之比是2:1
B.该浓硝酸中HNO3的物质的量浓度是14.0mol·L-1
C.NO2和N2O4的混合气体中,NO2和N2O4的物质的量之比是1:4
D.得到2.54g沉淀时,加入NaOH溶液的体积是640mL
难度: 中等查看答案及解析