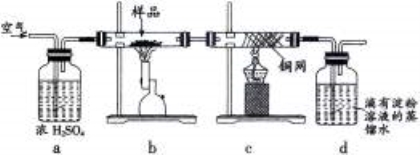
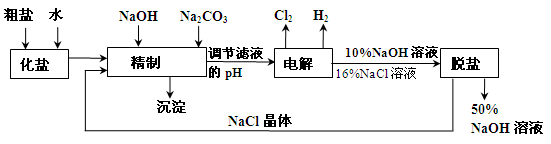
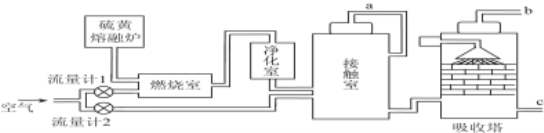
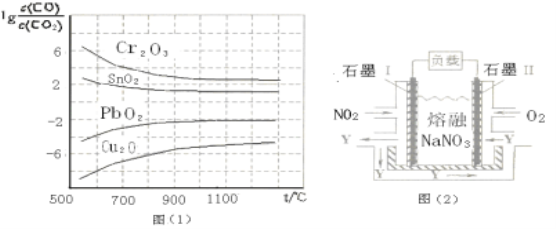
-
下列化学用语正确的是
A.乙烯分子的电子式
B.硫原子的结构示意图
C.淀粉的化学式 (C6H10O5)n
D.硫酸铁的电离方程式 Fe2(SO4)3 = 2Fe2+ + 3SO42ˉ
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的数值,下列说法正确的是
A.常温下,23g NO2含有NA个氧原子
B.标准状况下,11.2L SO3中含有的分子数为0.5NA
C.1 mol Cl2做氧化剂转移的电子数是NA
D.1L 0.1mol/L-1的氨水中含OH―离子数为0.1NA个
难度: 中等查看答案及解析
-
下列叙述正确的是
A.0.1mol·L-1CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B.NH4Cl溶液加水稀释后,恢复至原温度,pH和KW均增大
C.pH=4的CH3COOH溶液和pH=4的NH4Cl溶液中,c(H+)不相等
D.在NaHCO3溶液中:c(OH-)+c(CO32-)=c(H+)+c(H2CO3)
难度: 中等查看答案及解析
-
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的内层电子总数是最外层电子数的5倍。下列说法中不正确的是
A.W、M的某种单质可作为水处理中的消毒剂
B.电解YW2的熔融物可制得Y和W的单质
C.相同条件下,W的氢化物水溶液酸性比Z弱
D.X、M两种元素形成的一种化合物与水反应可生成M的某种单质
难度: 中等查看答案及解析
-
下列因果关系叙述正确的是
A.SO2具有漂白性,故可使酸性KMnO4溶液褪色
B.浓硝酸中的HNO3见光会分解,故有时在实验室看到的浓硝酸呈黄色
C.Na的金属性比Cu强,故可用Na与CuSO4溶液反应制取Cu
D.Fe在Cl2中燃烧生成FeCl3,故在与其他非金属反应的产物中Fe也显+3价
难度: 中等查看答案及解析
-
某有机物结构简式如图,下列关于它的说法正确的是
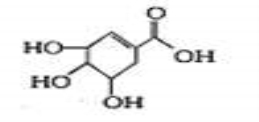
A.分子式为C7H6O5 B.分子中含有两种官能团
C.可发生加成和取代反应 D.在水溶液中羟基和羧基均能电离出氢离子
难度: 中等查看答案及解析
-
一种新型燃料电池,是用两根金属铂做电极插入KOH溶液中,然后向两极上分别通入CH3OH和O2,下解说法不正确的是
A.通入CH3OH的电极为负极
B.随着放电的进行,负极附近pH上升
C.每消耗1molCH3OH可以向外电路提供6mol e-
D.通入O2的一极电极反应为 4H2O + 2O2 - 8e- = 8OH-。
难度: 中等查看答案及解析