-
下列说法正确的是( )
A. 对煤进行分馏可以得到许多芳香族化合物
B. 点燃爆竹后,硫燃烧生成SO3,汽车尾气排放的SO2都会引起酸雨
C. “光化学烟雾”“臭氧空洞”“硝酸型酸雨”的形成都与氮氧化合物有关
D. 绚丽缤纷的烟花中添加了含有铁、铂、钾、钙、铜等金属化合物
难度: 简单查看答案及解析
-
设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
A. O2和O3、H2和D2、N60和N2都互为同素异形体
B. 60gSiO2晶体中含有Si-O键的数目为2NA
C. 在K35ClO3+6H37Cl=KCl+3Cl2↑+3H2O中,若生成71gCl2转移的电子数目为5/3NA
D. 78gNa2O2与足量的CO2反应时转移电子数为NA
难度: 中等查看答案及解析
-
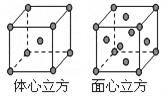
立方烷(球棍模型:
 )具有高度的对称性,Eatom教授在此基础上经七步反应合成了二羧基立方烷(C10H8O4)。二羧基立方烷的同分异构体数目为( )
)具有高度的对称性,Eatom教授在此基础上经七步反应合成了二羧基立方烷(C10H8O4)。二羧基立方烷的同分异构体数目为( )A. 1 B. 3
C. 4 D. 5
难度: 简单查看答案及解析
-
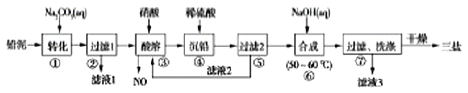
X、Y、Z、W是短周期主族元素,且原子序数依次增大,X元素的周期序数等于其主族序数,且X为同主族元素中唯一非金属元素,Y元素的单质是一种强力漂白剂,Z元素形成的简单离子是同周期半径最小的离子,含元素W的一种化合物是木材防火剂的原料,下列叙述错误的是( )
A. 上述四种元素的原子半径大小:Z>W>Y>X
B. Z的氢氧化物和NaHCO3均可中和过多的胃酸,治疗胃溃疡
C. X与Y可形成既含极性共价键又含非极性共价键的共价化合物
D. W与Y形成的化合物既是建筑材料,也是工艺品(玛瑙等)的原料
难度: 中等查看答案及解析
-
下列说法错误的是( )
A. 在精炼铜或电镀铜的过程中,当阴极析出铜32g,转移电子均为1 mol
B. 向0.1mol/L的CH3COONa落成中加入少量NaHSO4固体,所得溶液中存在:c(CH3COOH)+c(CH3COO-)=c(Na+)-c(SO42-)
C. 0.1mol/LNaHSO4溶液中通入NH3至溶液pH=7,所得溶液中存在: c(Na+)=c(SO42-)=c(NH4+)
D. 室温下,将0.2 mol/L的一元酸HA和0.1 mol/L的NaOH溶液等体积混合后,溶液显碱性,所得溶液中存在:c(A-)>c(Na+)>c(HA)>c(OH-)>c(H+)
难度: 中等查看答案及解析
-
下列实验中,对应的操作、现象以及结论均正确的是( )
选项
实验操作
实验现象
结论
A
将铜粉加入到浓硫酸中
无明显现象
铜被浓硫酸钝化
B
将表面氧化的钢丝从酒精灯的外焰慢慢移向内焰
黑色的铜丝变红色
氧化铜被酒精灯内焰的乙醇蒸汽还原
C
将混有乙酸的乙酸乙酯加入到分液漏斗中,加入氢氧化钠溶液,震荡、静置、分液
溶液分层
除去乙酸乙酯中的乙酸
D
分别向两只试管中加入同浓度、同体积的草酸溶液,再分别加入同体积、不同浓度的酸性高猛酸钾溶液
酸性高锰酸钾溶液褪色时间不同
浓度不同反应速率不同
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
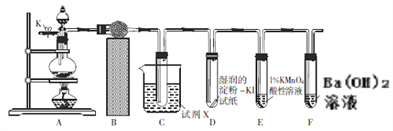
如图为一种固体离子导体电池与湿润KI试纸AB连接,Ag+可以在RbAg4I5晶体中迁移,空气中的氧气透过聚四氯乙烯膜与AlI3反应生成I2,Ag与I2作用形成电池。下列说法中正确的是( )

A. 试纸B端发生氧化反应 B. Ag+从石墨电极移向银电极
C. 试纸A端发生反应: 2I--2e-=I2 D. 若该电池转移1mol电子,则滤纸上生成8gO2
难度: 中等查看答案及解析

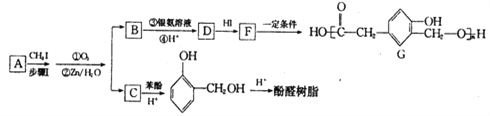
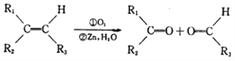 (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)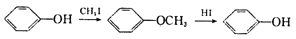
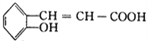 有多种同分异构体,写出同时满足下列条件的一种同分异构体的结构简式_________。
有多种同分异构体,写出同时满足下列条件的一种同分异构体的结构简式_________。