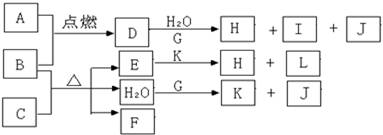
-
下列图式正确的是
A.氟化氢的电子式:
B.次氯酸的结构式: H-Cl-O
C.铝离子的结构示意图
D.氯化铯的晶体结构(晶胞)模型:
难度: 中等查看答案及解析
-
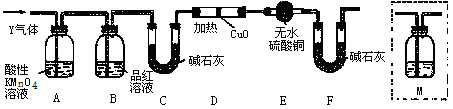
下列有关实验事故的处理或实验操作的叙述中,正确的是
A.浓硫酸不小心沾到皮肤上,立即用稀NaOH溶液洗涤
B.用分液漏斗将乙醇和水的混合液体分离
C.若皮肤不慎沾到苯酚,应立即用酒精清洗
D.为了测定某溶液的pH,将未经湿润的pH试纸浸入到待测溶液,过一会取出,与标准比色卡进行对比
难度: 中等查看答案及解析
-
25℃时,PH和体积均相等的氨水和烧碱溶液中c(NH4+)与c(Na+)关系正确的是
A.c(NH4+)>c(Na+) B.c(NH4+)=c(Na+)
C.c(NH4+)<c(Na+) D.无法判断
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是
A.铜片插入氯化铁溶液中 Cu+Fe3+=Cu2++Fe2+
B.电解饱和食盐水 2Cl—+2H+
H2↑+C12↑
C.向溴化亚铁溶液中通入过量的氯气
2Fe2++Cl2=2Fe3++2Cl-
D.向硫酸铝铵[NH4Al(SO4)2]溶液中滴加足量Ba(OH)2溶液
NH4++Al3++2SO42—+2Ba2++5OH-=AlO2-+2BaSO4↓+NH3·H2O+2H2O
难度: 中等查看答案及解析
-
下列各组离子一定能大量共存的是
A.含有大量硝酸根离子的溶液中H+ 、Fe2+ 、SO42- 、Cl-
B.c(H + )/c(OH - ) = 1×10-10 的溶液中NH4+ 、K+ 、Ca2+ 、Cl-
C.加入铝粉有氢气产生的溶液中Na+ 、K+ 、SO42- 、Cl-
D.水电离的c(H + ) = 1×10-12mol/L 的溶液中Na+ 、K+ 、HCO-3 、Cl-
难度: 中等查看答案及解析
-
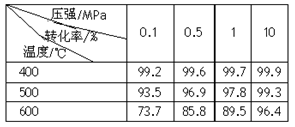
某温度下,
 的平衡常数
的平衡常数.该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示。下列判断不正确的是
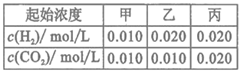
A.平衡时,乙中CO2的转化率大于60%
B.平衡时,甲中和丙中H2的转化率均是60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012mol/L
D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
难度: 中等查看答案及解析
-
下列各组热化学方程式中,化学反应的△H前者大于后者的是
①C(s)+O2(g)=CO2(g); △H1 C(s)+ O2(g)=CO(g); △H2
②2H2(g)+O2(g)=2H2O(g); △H3 2H2(g)+O2(g)=2H2O(1); △H4
③CaCO3(s)=CaO(s)+CO2(g); △H5 CaO(s)+H2O(1)=Ca(OH)2(s); △H6
A.①② B.①③ C.②③ D.只有②
难度: 中等查看答案及解析