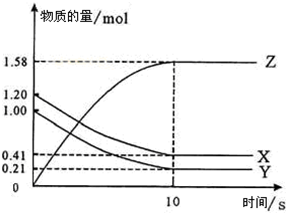
-
常温下,盐酸与氨水混合,所得溶液pH=7,则此溶液中的关系正确是( )
A.c(NH4+)<c(Cl-)
B.c(NH4+)=c(Cl-)
C.c(NH4+)>c(Cl-)
D.无法确定c(NH4+)与c(Cl-)难度: 中等查看答案及解析
-
有一支50mL的酸式滴定管,其中盛有溶液,液面恰好在30mL处,把管中的溶液全部放出,承接在量筒中溶液的体积是( )
A.等于30mL
B.等于20mL
C.大于20mL
D.大于30mL难度: 中等查看答案及解析
-
2011年西安世园会以“城市与自然和谐共生”为主题,倡导“绿色引领时尚”,集中展现绿色、生态、节能、环保的生活理念.下列做法不符合节能、环保理念的是( )
A.鼓励市民乘公交车前往世园会,少开私家车
B.鼓励世园会游客使用聚乙烯塑料餐盒和一次性筷子
C.利用地下水循环系统保持世园会场馆温度
D.利用风能发电照明世园会园区难度: 中等查看答案及解析
-
下列物质中属于电解质的是( )
A.硫酸铜
B.石墨
C.乙醇
D.二氧化碳难度: 中等查看答案及解析
-
在电解水制取H2和O2时,为了增强溶液的导电性,常加入一些电解质.下列物质中最合适的是( )
A.NaCl
B.CuC12
C.Na2SO4
D.AgNO3难度: 中等查看答案及解析
-
下列有关金属腐蚀与防护的说法正确的是( )
A.纯银器表面在空气中因电化学腐蚀而渐渐变暗
B.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀
C.钢柱在水下部分比在空气与水交界处更容易腐蚀
D.当镀锌铁制品的镀层受损后,镀层仍能对铁制品起保护作用难度: 中等查看答案及解析
-
下列过程或现象与盐类水解无关的是( )
A.向Na2CO3溶液中滴加酚酞试液变红色
B.实验室保存硫酸亚铁溶液时加入少量铁粉
C.加热FeCl3溶液颜色会变深
D.KAl(SO4)2•12 H2O可用于净水难度: 中等查看答案及解析
-
在2A+B═3C+4D反应中,表示该反应速率最快的是( )
A.υ(B)=0.3 mol•-1
B.υ(A)=0.5 mol•-1
C.υ(C)=0.8 mol•-1
D.υ(D)=1 mol•-1难度: 中等查看答案及解析
-
野外作业时,可用原电池反应放出的热量来加热食品.由铁屑、炭粒、食盐、水、空气组成的原电池中,铁屑( )
A.作正极,发生还原反应
B.作负极,发生氧化反应
C.作阴极,发生还原反应
D.作阳极,发生还原反应难度: 中等查看答案及解析
-
在一定条件下,可用△H-T△S作为化学反应方向的判据,△H为焓变,△S为熵变.据此,下列叙述中正确的是( )
A.熵变大于零的反应肯定能自发进行
B.焓变小于零的反应肯定能自发进行
C.焓变大于零的反应肯定不能自发进行
D.焓变小于零且熵变大于零的反应一般能自发进行难度: 中等查看答案及解析
-
若NA表示阿佛加德罗常数,下列说法正确的是( )
A.电解精炼铜时,阴极质量每增加63.5g时转移的电子数是2NA
B.5.6L Cl2与足量铁粉反应时转移的电子数为0.5NA
C.1L 1mol•L-1的CH3COOH溶液中含有H+的数目是NA
D.1L 0.5mol•L-1的Na2CO3溶液中含有CO的数目是0.5NA
难度: 中等查看答案及解析
-
下列有关实验原理或实验操作正确的是( )
A.用蒸馏水湿润的pH试纸测量某溶液的pH=10
B.用10 mL量筒量取0.5000 mol•L-1H2SO4溶液5.50 mL
C.向铁钉上镀铜时,铁钉连接直流电源的正极
D.向AgCl沉淀中滴加KI溶液,白色沉淀转化为黄色难度: 中等查看答案及解析
-
在指定的条件下,下列各组离子一定能大量共存的是( )
A.无色的溶液中:Fe3+、K+、NO3-、Cl-
B.pH=13的溶液中:NH4+、Na+、SO42-、Cl-
C.含有大量Ba2+的溶液中:NH4+、Na+、Cl-、H+
D.c(H+)=0.1 mol•L-1的溶液中:K+、I-、Cl-、NO3-难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是( )
A.电解饱和食盐水时,阴极的电极反应式为:2Cl--2e-=Cl2↑
B.用FeCl3溶液腐蚀铜板:Cu+Fe3+=Cu2++Fe2+
C.NH4HCO3溶液与过量NaOH稀溶液反应:NH4++OH-=NH3•H2O
D.向Ca(ClO)2溶液中通入过量的CO2气体:ClO-+CO2+H2O=HCO3-+HClO难度: 中等查看答案及解析
-
有关AgCl的沉淀溶解平衡的说法中,不正确的是( )
A.AgCl难溶于水,溶液中没有Ag+和Cl-
B.升高温度时,AgCl的溶解度增大
C.向AgCl饱和溶液中,加入NaCl固体,会析出AgCl固体
D.达到沉淀溶解平衡时,AgCl沉淀生成和沉淀溶解不断进行,但速率相等难度: 中等查看答案及解析
-
在恒容密闭容器中存在下列平衡:C(s)+H2O(g)⇌CO(g)+H2(g).CO(g)的平衡物质的量浓度c(CO)与温度T的关系如图所示.下列说法错误的是( )
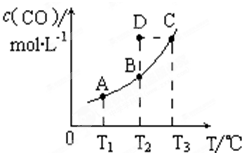
A.该反应的△H>0
B.通过加热可以使B点变到C点
C.若T1、T2时的平衡常数分别为K1、K2,则K1=K2
D.在T2时若反应进行到状态D,则一定有υ(正)<υ(逆)难度: 中等查看答案及解析