(1)已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ•mol−1。若向三份等体积、等物质的量浓度的NaOH溶液中分别加入醋酸、浓硫酸、稀硝酸至恰好完全反应,并将上述过程中放出的热量分别记为Q1 kJ、Q2 kJ、Q3 kJ。则三者的由小到大关系是________(用Q1、Q2、Q3表示)。
(2)如图所示A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃搅拌棒,两个小孔不能开得过大,其目的是_____________________; 若实验中不加盖泡沫塑料板,则求得的中和热数值______(填偏大、偏小、无影响)。
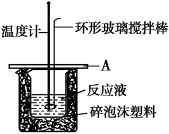
(3)实验室用50 mL 0.50 mol•L−1盐酸、50 mL 0.55 mol•L−1 NaOH溶液利用上图装置,进行测定中和热的实验。假设盐酸和氢氧化钠溶液的密度都是1 g/cm3,又知中和后生成溶液的比热容c=4.18 J/(g•℃)。为了计算中和热,实验时还需测量的数据有(填序号)________。
A.反应前盐酸的温度 B.反应前盐酸的质量
C.反应前氢氧化钠溶液的温度 D.反应前氢氧化钠溶液的质量
E.反应后混合溶液的最高温度 F.反应后混合溶液的质量
(4)某学生实验记录数据如下:
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ |
| 盐酸 | 氢氧化钠溶液 | 混合溶液 |
| 1 | 20.0 | 20.1 | 23.4 |
| 2 | 20.2 | 20.4 | 23.6 |
| 3 | 20.5 | 20.6 | 23.8 |
| | | |
依据该学生的实验数据计算,该实验测得的中和热ΔH为________。(保留三位有效数字)
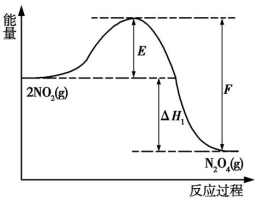
N2O4(g)反应过程的能量变化如图所示。