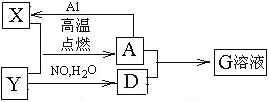
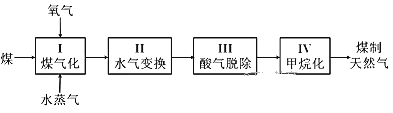
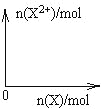-
下列实验中,对应的现象以及解释或结论都正确,且两者具有因果关系的是
选项
实验
现象
结论或解释
A
将0.1 mol·L-1 MgSO4溶液滴入过量NaOH溶液,再滴加几滴0.1 mol·L-1 CuSO4溶液
先有白色沉淀生成,后有蓝色沉淀生成
Ksp[Cu(OH)2]<Ksp[Mg(OH)2]
B
将一片铝箔置于酒精灯外焰上灼烧
铝箔熔化但不滴落
下来
铝箔表面有致密Al2O3薄膜,且Al2O3的熔点高于Al
C
向新收集的酸雨中滴加硝酸钡溶液
产生白色沉淀
酸雨中一定含有SO42-
D
取久置的Na2O2粉末,向其中
滴加过量的盐酸
产生无色气体
Na2O2没有变质
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列叙述不正确的是
A
B
C
D




闪电时会发生反应:
N2 + O2 === 2NO
玛瑙主要成分SiO2
蔗糖中加入浓硫酸搅拌后变黑,因为浓硫酸有吸水性
漂白粉主要成分
Ca(ClO)2和CaCl2
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列有关物质分类或归类正确的一组是
① 液氨、液氯、干冰、碘化银均为化合物
② 氢氟酸、盐酸、水玻璃、氨水均为混合物
③ 明矾、小苏打、冰醋酸、次氯酸均为电解质
④ Na2O2、Na2CO3、NaHCO3、Na2SiO3均为钠盐
A. ①和③ B. ②和③ C. ③和④ D. ②和④
难度: 简单查看答案及解析
-
下列有关胶体的说法不正确的是
A. 胶体均为无色透明的液体
B. 利用丁达尔效应可以区分胶体和溶液
C. 胶体中分散质粒子的直径在1~100 nm之间
D. 向沸水中逐滴加入少量FeCl3饱和溶液,可制得Fe(OH)3胶体
难度: 简单查看答案及解析
-
下列说法不正确的是
A. 以次氯酸钠为有效成分的漂白液可为泳池消毒
B. “酸雨”主要是由大气中含有较高浓度的硫和氮的氧化物造成的
C. Cl2和SO2都能使紫色石蕊试液先变红后褪色
D. 碳素钢、不锈钢、硬铝、黄铜都属于合金
难度: 中等查看答案及解析
-
下列关于硅及其化合物的说法不正确的是
A. 水玻璃可用作木材防火剂 B. 硅是制造光导纤维的材料
C. 硅是制造太阳能电池的常用材料 D. 硅是构成一些岩石和矿物的基本元素
难度: 简单查看答案及解析
-
下列在限定条件溶液中的各组离子,能够大量共存的是
A. 在pH=1的溶液中:K+、Fe3+、Cl-、NO3-
B. 与Al能产生氢气的溶液:K+、SO42-、CO32-、NH4+
C. 使酚酞试液变红的溶液: Na+、Cl-、SO42-、Al3+
D. c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO42-、SCN-
难度: 中等查看答案及解析
-
下列解释事实的方程式不正确的是
A. 向燃煤中加入石灰石可减少SO2的排放:2CaCO3 + O2 + 2SO2
2CaSO4 + 2CO2
B. 足量铁粉与稀硝酸反应:Fe+4H++NO3- = Fe3++2H2O+NO↑
C. 用氨水除去烟气中的SO2:SO2+2NH3•H2O=(NH4)2SO3+H2O
D. 用熟石灰处理泄漏的液氯:2Ca(OH)2 +2Cl2 = CaCl2 + Ca(ClO)2 +2H2O
难度: 中等查看答案及解析
-
下列反应过程中的能量变化情况符合如图的是
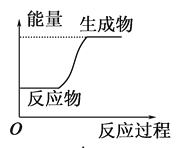
A. 酸与碱的中和反应 B. 镁和盐酸的反应
C. 氧化钙和水反应 D. 水发生分解反应
难度: 简单查看答案及解析
-
为除去MgCl2溶液中的FeCl3,可在加热搅拌的条件下加入一种试剂,该试剂是 ( )
A. NaOH B. Na2CO3 C. 氨水 D. MgO
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的数值,下列叙述不正确的是
A. 16 g氧气中含有的氧原子数目为NA
B. 10.6 g Na2CO3含有Na+的数目为0.2 NA
C. 标准状况下,22.4 L Cl2含有的电子数约为34NA
D. 标准状况下,22.4 L 乙醇中含有的分子数为NA
难度: 简单查看答案及解析
-
下列解释事实的化学方程式或离子方程式正确的是
A. 用食醋除去暖水瓶中的水垢:2CH3COOH+CaCO3===Ca2++2CH3COO-+CO2↑+H2O
B. NaOH溶液中通入Cl2 :2Cl2 + 2OH- = 3Cl- + ClO- + H2O
C. 稀硫酸中加入铁粉 2Fe+6H+===2Fe3++3H2↑
D. Ca(HCO3)2溶液中加入少量的NaOH溶液:Ca2++2HCO+2OH-===CaCO3↓+CO
+2H2O
难度: 中等查看答案及解析
-
茶叶中铁元素检验可用以下步骤完成,各步骤选用实验用品不能都用到的( )
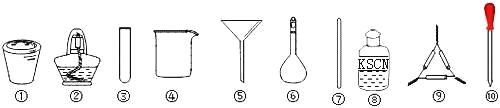
A. 将茶叶灼烧灰化,选用①、②和⑨
B. 过滤得到滤液,选用④、⑤和⑦
C. 用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦
D. 检验滤液中的Fe3+,选用③、⑧和⑩
难度: 简单查看答案及解析
-
在25℃时,在浓度为1mol/L的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2的溶液中,测其c(NH4+)分别为a、b、c(单位为mol/L),下列判断正确的是
A. a=b=c B. a>b>c C. a>c>b D. c>a>b
难度: 简单查看答案及解析
-
已知Fe3O4可表示为(FeO·Fe2O3),水热法制备Fe3O4纳米颗粒的总反应的离子方程式为3Fe2+ + 2S2O32- + O2 + 4OH- = Fe3O4 + S4O62- + 2H2O,下列说法正确的是( )
A. O2和S2O32-是氧化剂,Fe2+是还原剂
B. 每生成1 mol Fe3O4,转移2 mol电子
C. 若有2 mol Fe2+被氧化,则被Fe2+还原的O2为0.5 mol
D. 参加反应的氧化剂与还原剂的物质的量之比为1∶5
难度: 困难查看答案及解析
-
某温度下,
分别在溶液中达到沉淀溶解平衡后,改变溶液
,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是
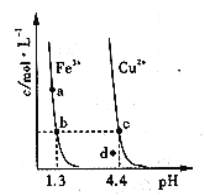
A.
B.加适量
固体可使溶液由
点变到
点
C.
两点代表的溶液中
与
乘积相等
D.
、
分别在
、
两点代表的溶液中达到饱和
难度: 困难查看答案及解析
-
氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图。下列有关氢氧燃料电池的说法正确的是( )

A. 该电池工作时电能转化为化学能
B. 该电池中电极b是负极
C. 外电路中电子由电极b通过导线流向电极a
D. 该电池是绿色环保电池
难度: 中等查看答案及解析
-
右图是关于反应A2(g)+3B2(g)
2C(g)(正反应为放热反应)的平衡移动图象,影响平衡移动的原因可能是( )
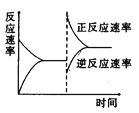
A. 升高温度,同时加压
B. 降低温度,同时减压
C. 增大反应物浓度,同时减小生成物浓度
D. 增大反应物浓度,同时使用催化剂
难度: 中等查看答案及解析
-
一定温度下,向10 mL 0.40 mol·L-1 H2O2溶液中加入适量FeCl3溶液,不同时刻测得生成O2的体积(已折算为标准状况)如下表所示:
t / min
0
2
4
6
V(O2) / mL
0
9.9
17.2
22.4
资料显示,反应分两步进行:① 2Fe3++H2O2 == 2Fe2++O2↑+2H+,② H2O2+2Fe2++2H+ == 2H2O+2Fe3+。反应过程中能量变化如下图所示。下列说法错误的是
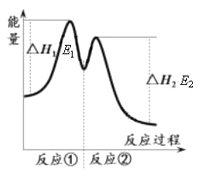
A. Fe3+的作用是增大过氧化氢的分解速率
B. 反应①是吸热反应、反应②是放热反应
C. 反应2H2O2(aq) == 2H2O(l)+O2(g)的ΔH=E1-E2<0
D. 0~6 min的平均反应速率:v(H2O2)=3.33×10-2 mol·L-1·min-1
难度: 困难查看答案及解析