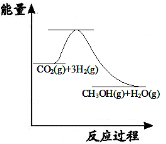
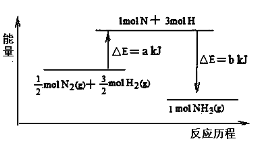
-
已知:HCN(aq)与NaOH(aq)反应的ΔH=−12.1 kJ·mol−1;HCl(aq)与NaOH(aq)反应的ΔH=−55.6 kJ·mol−1,则HCN在水溶液中电离的ΔH等于
A.−67.7 kJ · mol−1 B.−43.5 kJ · mol−1
C.+43.5 kJ · mol−1 D.+67.7 kJ · mol−1
难度: 中等查看答案及解析
-
相同条件下,下列各反应均为放热反应,其中ΔH值最小的是
A.2A(g) +B(g)
2C(l) ΔH1
B.2A (g) +B(g)
2C(g) ΔH2
C.2A (l)+B(l)
2C(g) ΔH3
D.2A (l) + B(l)
2C(l) ΔH4
难度: 中等查看答案及解析
-
已知H—H键能436 kJ/mol;Cl—Cl键能243 kJ/mol;H—Cl键能431 kJ/mol,则下列热化学方程式正确的是
A.H2(g)+Cl2(g)=2HCl(g) ΔH=−183 kJ/mol
B.1/2H2(g)+1/2Cl2(g)=HCl(g) ΔH=−124 kJ/mol
C.2HCl(g)=H2(g)+Cl2(g) ΔH=−248 kJ/mol
D.HCl(g) =1/2H2(g)+1/2Cl2(g) ΔH=−91.5 kJ/mol
难度: 中等查看答案及解析
-
已知葡萄糖的燃烧热是ΔH=−2 840 kJ·mol−1,当它氧化生成1 g液态水时放出的热量是
A.26.3 kJ B.51.9 kJ C.155.8 kJ D.467.3 kJ
难度: 中等查看答案及解析
-
已知:Fe2O3(s)+3C(石墨)
2Fe(s)+3CO(g) ΔH=+489.0 kJ·mol−1①
CO(g)+
O2(g)
CO2(g) ΔH=−283.0 kJ·mol−1②
C(石墨)+O2(g)
CO2(g) ΔH=−393.5 kJ·mol−1③
则4Fe(s)+3O2(g)
2Fe2O3(s)的ΔH为
A.+1 164.1 kJ·mol−1 B.−1 641.0 kJ·mol−1
C.−259.7 kJ·mol−1 D.−519.4 kJ·mol−1
难度: 中等查看答案及解析
-
符合如图所示的转化关系,且当X、Y、Z的物质的量相等时,存在焓变ΔH=ΔH1+ΔH2。满足上述条件的X、Y可能是
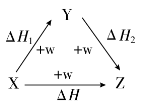
①C、CO ②S、SO3 ③Na、Na2O
④AlCl3、Al(OH)3 ⑤Fe、Fe(NO3)2 ⑥NaOH、Na2CO3
A.①④⑤ B.①②③ C.①③④ D.①③④⑤⑥
难度: 中等查看答案及解析