-
下列常见物质溶于水显著放热的是
A. 食盐 B. 食醋 C. 酒精 D. 碱石灰
难度: 中等查看答案及解析
-
下列属于化学变化的是( )
A. 干冰升华 B. 萃取分液 C. 钢铁生锈 D. 海水晒盐
难度: 简单查看答案及解析
-
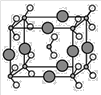
下列物质灼烧时,透过蓝色钴玻璃能看到紫色火焰的是( )
A. NaCl B. K2SO4 C. CaCl2 D. CuSO4
难度: 简单查看答案及解析
-
能产生丁达尔效应的分散系是( )
A. CuSO4溶液 B. 盐酸 C. Fe(OH)3胶体 D. KOH溶液
难度: 简单查看答案及解析
-
下列元素中最高正化合价为+7价的是( )
A. Cl B. H C. N D. He
难度: 简单查看答案及解析
-
第三周期元素中,原子半径最小的是( )
A. Na B. Cl C. Si D. F
难度: 简单查看答案及解析
-
下列食物属于碱性食物的是( )
A. 牛肉 B. 海带 C. 猪肉 D. 鸡蛋
难度: 简单查看答案及解析
-
对人体健康不会造成危害的事实是( )
A. 用工业酒精(含甲醇)兑制饮用白酒
B. 用福尔马林浸泡海产品进行防腐保鲜
C. 长期饮用长时间反复加热沸腾的水
D. 在食用盐中加入碘酸钾以消除碘缺乏病
难度: 中等查看答案及解析
-
已知①NO + NO=N2O2(快反应),②N2O2 + H2= N2O + H2O(慢反应),③N2O + H2=N2 + H2O(快反应)。下列说法正确的是
A. 整个过程中,反应速率由快反应步骤 ①、③ 决定
B. N2O2、N2O是该反应的催化剂
C. 当 v(NO)正 =v(N2)逆 时反应达到平衡状态
D. 总反应的化学方程式为2NO + 2H2=N2 + 2H2O
难度: 困难查看答案及解析
-
在无色酸性溶液中能大量共存的离子组是( )
A. NH4+、Fe3+、SO42-、Cl- B. Ba2+、K+、OH-、NO3-
C. Al3+、Cu2+、SO42-、Cl- D. Na+、Ca2+、Cl-、NO3-
难度: 中等查看答案及解析
-
下列离子方程式的书写正确的是( )
A. 钠和水反应:2Na+H2O = 2Na++OH-+H2↑
B. 氯化镁溶液中加入氨水:Mg2++2OH-= Mg(OH)2↓
C. 氢氧化钡与稀硫酸反应:Ba2++SO42-= BaSO4↓
D. 氯气通入FeCl2溶液中:Cl2 + 2Fe2+ = 2Cl-+ 2Fe3+
难度: 简单查看答案及解析
-
实验室中配制250mL 0.10mo1·L-1NaCl溶液时,必须使用到的玻璃仪器是( )

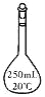
A. 锥形瓶 B. 试管 C. 分液漏斗 D. 容量瓶
难度: 简单查看答案及解析
-
下图是某种酶生物燃料电池的工作原理示意图。下列说法中不正确的是

A. 葡萄糖是还原剂
B. 外电路中电子由A极移向B极
C. 溶液中H+ 由B极区移向A极区
D. B极电极反应式为:H2O2 +2H++2e-=== 2H2O
难度: 中等查看答案及解析
-
反应H2(g) + I2(g)
2HI(g)的逆反应速率随时间变化的曲线如下图所示,t1时刻反应达到平衡,维持其他条件不变,t1时刻只改变一种条件,该条件可能是
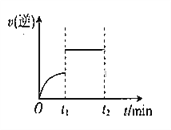
①增大H2浓度 ②缩小容器体积 ③恒容时充入Ar气 ④使用催化剂
A. ①② B. ③④ C. ②④ D. ①④
难度: 困难查看答案及解析
-
在一定条件下,将X和Y两种物质按不同的比例放入密闭容器中反应,平衡后测得X、Y的转化率与起始时两物质的物质的量之比n(X)/ n(Y)的关系如图所示,则X、Y反应的化学方程式可表示为
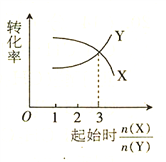
A. 2X + Y
3Z B. 3X + 2Y
2Z
C. X + 3Y
Z D. 3X + Y
Z
难度: 中等查看答案及解析
-
恒温下,可逆反应aA(g) + bB(g)
cC(g)达到平衡时,测得C的浓度c1。增大压强,待各组分的浓度保持恒定时,测得C的浓度为c2。则c1与c2的关系正确的是
A. 可能有c1 = c2 B. 一定有c1 < c2 C. 一定有c1 > c2 D. 无法判断
难度: 困难查看答案及解析
-
已知苯甲醇的催化氧化反应中能量变化如图所示。下列说法正确的是

A. 该反应的焓变 △H > 0
B. 加入催化剂,降低活化能
C. 该反应不需要加热就能发生
D. 正反应活化能大于逆反应活化能
难度: 中等查看答案及解析
-
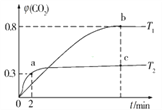
已知分解反应2N2O5(g)
4NO2(g) + O2(g)的速率方程式v = k·cm(N2O5),k是与温度有关的常数,实验测定340K时的有关数据及根据相关数据做出的图像如下:

依据图表中的有关信息,判断下列有关叙述中不正确的是
A. 340K时,速率方程式中的m = 1
B. 340K时,速率方程式中的k = 0.350 min-1
C. 340K时,c(N2O5)= 0.100 mol·l-1时,v = 0.035 mol·l-1 ·min-1
D. 340K时,压强增大一倍,逆反应速率不变,正反应速率是原来的2倍
难度: 困难查看答案及解析
-
已知:2C(s)+O2(g)===2CO(g) ΔH=-Q1 kJ·mol-1;
C(s)+O2(g)===CO2(g) ΔH=-Q2 kJ·mol-1;
S(s)+O2(g)===SO2(g) ΔH=-Q3 kJ·mol-1。
CO与镍反应会造成镍催化剂中毒,为防止镍催化剂中毒,工业上常用SO2将CO氧化,二氧化硫转化为单质硫,则该反应的热化学方程式为 ( )
A. SO2(g)+2CO(g)===S(s)+2CO2(g) ΔH=(2Q1-2Q2+Q3) kJ·mol-1
B. S(s)+2CO(g)===SO2(g)+2C(s) ΔH=(Q1-Q3) kJ·mol-1
C. SO2(g)+2CO(g)===S(s)+2CO2(g) ΔH=(Q1-2Q2+Q3) kJ·mol-1
D. SO2(g)+2CO(g)===S(s)+2CO2(g) ΔH=(2Q1-Q2+2Q3) kJ·mol-1
难度: 困难查看答案及解析