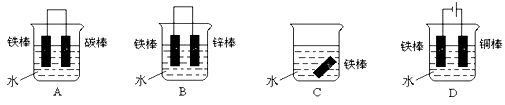
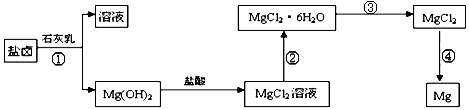
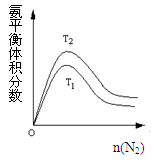
-
某温度下,水的离子积为Kw,该温度下将a mol·L-1的一元酸HA与b mol/L的一元碱BOH等体积混合,若混合液显中性,必须满足的条件是
A.a=b B.c(H+)=c(OH-)=10-7mol·L-1
C.混合液中Kw=c2(OH-) D.c(H+)+c(B+)=c(OH-)+c(A-)
难度: 中等查看答案及解析
-
下列说法正确的是
A.放热反应在任意条件下都能自发进行
B.已知热化学方程式2A(g)+B(g)
2C(g) △H=-a kJ·mol-1(a>0)将2molA(g)和1molB(g)置于一密闭容器中充分反应后放出akJ的热量
C.1mol·L-1的盐酸分别与1mol·L-1的氨水、1mol·L-1的NaOH溶液等体积混合,充分反应,后者比前者放出的热量多
D. BaCl2溶液中加过量H2SO4,溶液中一定不存在Ba2+
难度: 中等查看答案及解析
-
在一定温度下,两个恒容密闭容器中分别发生下列两个反应:①H2(g)+I2(g)
2HI(g) ②C(s)+H2O(g)
CO(g)+H2(g),下列状态能表明两反应都达到平衡状态的是
a.各物质的浓度不变 b.容器内气体压强不变
c. 容器内气体密度不变 d.容器内气体颜色不变
e.各组分的物质的量分数或质量分数不变
A.abc B.ade C.ac D.ae
难度: 中等查看答案及解析
-
下列电离方程式正确的是
A. HS- + H2O
S2- + H3O+ B.H2CO3
2H++CO32-
C.NaHCO3=Na++H++CO32- D.HSO3-+H2O
H2SO3+OH-
难度: 中等查看答案及解析
-
25℃时,水的电离达到平衡: H2O
H++OH― ΔH>0,下列叙述正确的是
A.向水中加入稀氨水,平衡逆向移动,c(OH―)降低
B.向水中加入少量固体NaHSO4,平衡逆向移动,Kw不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.将水加热,平衡逆向移动,Kw减小。
难度: 中等查看答案及解析
-
化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂;
HIn(溶液)
H+(溶液)+In-(溶液)
红色 黄色
浓度为0.02 mol·L-1的下列各溶液 ①盐酸 ②石灰水 ③NaCl溶液 ④NaHSO4溶液 ⑤NaHCO3溶液 ⑥氨水,其中能使指示剂显红色的是
A.①④⑤ B.②⑤⑥ C.①④ D.②③⑥
难度: 中等查看答案及解析
-
一定条件下,某反应达到平衡,其平衡常数为
恒容时,升高温度,混合气体的颜色加深,下列说法正确的是
A. 该反应的化学方程式为:NO2+CO===CO2+NO
B. 该反应的焓变为负值
C. 升高温度,正反应速率减小
D. 恒温时,增大压强,颜色加深,因平衡左移
难度: 中等查看答案及解析
-
将4molSO2和2molO2充入2L的密闭容器中,在一定条件下发生反应,经2s后测得SO3的浓度为0.6mol·L-1,下列说法中正确的是
①用O2表示的反应的平均速率为0.6mol·L-1·s-1
②用SO2表示的反应的平均速率为0.3mol·L-1·s-1
③2s时SO2的转化率为15%
④2s时O2的浓度为0.7mol·L-1
A. ①③ B. ①④ C..②③ D. ②④
难度: 中等查看答案及解析
-
在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中大量共存的有
A.滴加石蕊试液显红色的溶液:Fe3+ 、NH4+ 、Cl- 、I-
B.pH值为1的溶液:Cu2+、Na+ 、Mg2+、NO3-
C.水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+
D.所含溶质为Na2SO4的溶液:K+ 、CO32-、NO3-、Al3+
难度: 中等查看答案及解析
-
下图是电解NaCl溶液(加有酚酞)装置,其中c、d为石墨电极。下列有关的判断正确的是

A.a为负极、d为阳极
B.c电极上的电极反应式为:2H+ + 2e一= 2H2↑
C.电解过程中,d电极附近溶液变红
D.电解过程中,氯离子浓度不变
难度: 中等查看答案及解析
-
已知:在100℃时,纯水的c(H+)为1×10—6,此时将pH=12的NaOH溶液V1 L与pH=l的H2SO4溶液V2 L混合,若所得混合溶液的pH=10,则V1∶V2为
A.1∶9 B.10∶1 C.9∶1 D.1∶10
难度: 中等查看答案及解析
-
下列叙述不正确的是
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
C.原电池中电流由正极流向负极,阳离子向正极移动
D.用惰性电极电解AgNO3溶液一段时间后,加入一定质量Ag粉,溶液能恢复原状
难度: 中等查看答案及解析
-
实验室用足量镁粉与一定量的某浓度的盐酸反应来制得氢气。由于反应速率太快,不易操作。为减慢反应速率,同时又不影响生成H2的总量,可向盐酸中加入的物质是
A.CuSO4粉末 B.K2 SO4固体 C.(NH4)2 SO4粉末 D.CH3COONa固体
难度: 中等查看答案及解析
-
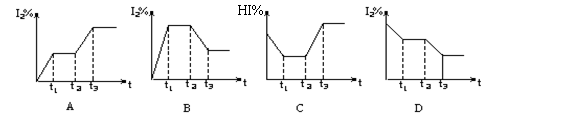
在某一密闭容器中,充入一定量的HI气体,发生反应2HI(g) H2(g)+I2(g); △H>0,在t1时达到平衡,t2时加热升温并保温,到t3时又达到新平衡,符合这一变化的图像是
难度: 中等查看答案及解析
-
银锌(Ag—Zn)可充电电池广泛用做各种电子仪器的电源,电解质为KOH。其电池总反应式为Ag2O + Zn + H2O
2Ag + Zn(OH)2 ,下列说法正确的是
A.放电时Zn参与反应的电极为正极
B.放电时负极附近的pH逐渐增大
C.充电时阴极的电极反应为:Zn(OH)2 -2e-= Zn + 2OH-
D.充电时每生成1 mol Ag2O转移2 mol电子
难度: 中等查看答案及解析
-
下列溶液中微粒的物质的量浓度关系正确的是
A.0.1mol/LNaHCO3溶液:c(Na+)>c(OH-)>c(HCO3-)>c(H+)
B.室温下,向0.01mol/LNH4HSO4溶液中滴加等体积0.01mol/LNaOH溶液:
c(Na+)=c(SO42-)>c(NH4+).>c(H+)>c(OH-)
C.Na2CO3溶液:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)
D.25℃时,浓度均为0.1mol/L的CH3COOH和CH3COONa等体积混合:
c(CH3COOH)+c(CH3COO-)=0.2mol/L
难度: 中等查看答案及解析
-
降低下列溶液的pH,而难溶电解质的溶解度保持不变的是
A.Al(OH)3 B.PbCl2 C.Ag3PO4 D.ZnCO3
难度: 中等查看答案及解析
-
下列说法正确的是
A.pH=5的盐酸,再加水冲稀1000倍,溶液的pH=8
B.给稀醋酸溶液适当加热,溶液pH值增大
C.pH=1的盐酸中c(H+)是pH=3的盐酸的100倍
D.在Na2CO3溶液中,C(Na+) :C(CO32-)=2∶1
难度: 中等查看答案及解析
-
电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。右图是KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线示意图。下列示意图中,能正确表示用NH3·H2O溶液滴定HCl和CH3COOH混合溶液的滴定曲线的是


难度: 中等查看答案及解析
-
常温下,将0.02 mol·L-1的Ba(OH)2溶液100mL和0.02 mol·L-1NaHSO4溶液100mL混合,若忽略溶液体积变化,则混合后的溶液
A.pH=12 B.溶质的物质的量浓度=0.02 mol·L-1
C.pH=2 D.由水电离的产生的c(H+)=1.0×10-2 mol·L-1
难度: 中等查看答案及解析
-
已知H—H键能为436 KJ/mol,H—N键能为391kJ/mol,根据化学方程式:N2(g) + 3H2(g) = 2NH3(g) ΔH=—92.4 kJ/mol,则N≡N键的键能是( )
A.431 kJ/mol B.946 kJ/mol C.649 kJ/mol D.869 kJ/mol
难度: 中等查看答案及解析
-
如图,A池用石墨电极电解NaOH溶液,B池精炼粗铜,一段时间后停止通电,A池中D极产生具有氧化性的气体在标准状况下为2.24L。下列说法正确的是
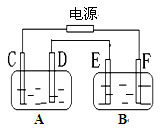
A.A池溶液的pH保持不变
B.D、E两极都发生氧化反应
C.E极应为粗铜板材料
D.B池中E极质量增加12.8g
难度: 中等查看答案及解析