-
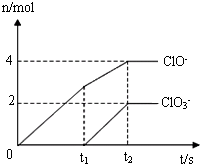
有一瓶久置的Na2SO3溶液,由于它可能部分被氧化,某同学进行如下实验:取少量样品溶液,滴入Ba(NO3)2溶液,产生白色沉淀,再加入足量稀硝酸,充分振荡后,仍有白色沉淀.对此实验下述结论正确的是( )
A.Na2SO3已部分被空气中的氧气氧化
B.加入Ba(NO3)2溶液后,生成的沉淀中一定含有BaSO4
C.加硝酸后的不溶性沉淀中含有BaSO4
D.此实验能确定Na2SO3是否部分被氧化
难度: 困难查看答案及解析
-
以下是一些常用危险化学品的标志,其中装运浓硫酸的包装箱应贴的图标是

难度: 简单查看答案及解析
-
化学与日常生活密切相关,下列说法错误的是
A.碘酒是指单质碘的乙醇溶液 B.84消毒液的有效成分是NaC1O
C.浓硫酸可刻蚀石英制艺术品 D.播撒碳酸钙粉末可治理被酸雨污染的湖泊
难度: 简单查看答案及解析
-
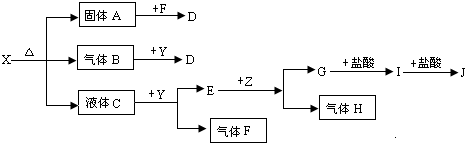
青海昆仑玉被定为2008年北京奥运会奖牌用玉,昆仑玉主要成分是由“透闪石”和“阳起石”组成的纤维状微晶结合体,透闪石(Tremolite)的化学成分为Ca2Mg5Si8O22(OH)2。下列有关说法不正确的是( )
A.透闪石的化学式写成氧化物的形式为:2CaO•5MgO•8SiO2•H2O
B.透闪石中Mg元素的质量分数是Ca元素质量分数的1.5倍
C.1 mol Ca2Mg5Si8O22(OH)2与足量的盐酸作用,至少需要14 mol HCl
D.透闪石是一种新型无机非金属材料,难溶于水
难度: 困难查看答案及解析
-
NA为阿伏加德罗常数的值。下列有关叙述正确的是
A.标准状况下,11.2 LSO3含有的分子数目为0.5 NA
B.1 mol SO2和CO2的混合气体中含有2NA个氧原子
C.足量的CO2与1 mol Na2O2充分反应,转移的电子数目为2NA
D.0.5 mol FeBr2与足量氯气反应转移的电子数为NA
难度: 困难查看答案及解析
-
往FeCl3和Ba Cl2的混合溶液中通入SO2,溶液颜色由棕黄色变成浅绿色,同时有白色沉淀产生。下列说法正确的是
A.该实验表明FeC13有还原性
B.白色沉淀为BaSO3
C.白色沉淀为BaSO4
D.反应后溶液酸性减弱
难度: 困难查看答案及解析
-
SO2和Cl2都具有漂白性,若将等物质的量的这两种气体同时作用于潮湿的有色物质,可观察到有色物质
A.立刻褪色 B.慢慢褪色 C.先褪色,后复原 D.颜色不褪去
难度: 中等查看答案及解析
-
下列标有横线的物质在给定的条件下不能完全反应的是
①1mol Zn与含1mol H2SO4的稀硫酸溶液反应
②1mol Cu与含2mol H2SO4的浓硫酸溶液共热
③1mol Cu与含4mol HNO3的浓硝酸溶液反应
④1mol MnO2与含4mol HCl的浓盐酸溶液共热
A.①③ B.①② C.②④ D.③④
难度: 困难查看答案及解析
-
和氢硫酸反应不能产生沉淀的是
A.FeC13溶液 B.Na2S溶液 C.CuSO4溶液 D.浓H2SO4溶液
难度: 中等查看答案及解析
-
含有下列离子或分子的溶液中,通入过量SO2气体后仍能大量共存的是
A.H+、Ca2+、Fe3+、NO3-
B.Ba2+、Cl-、Al3+、H+
C.Na+、NH4+、I-、HS-
D.Na+、Ca2+、K+、Cl-
难度: 困难查看答案及解析
-
浓硫酸有许多重要的性质,在与含有水份的蔗糖作用过程中不能显示的性质是
A.酸性 B.吸水性 C.强氧化性 D.脱水性
难度: 中等查看答案及解析
-
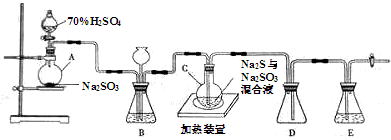
用如图所示装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应.下列实验不合理的是( )
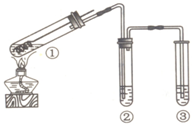
A.上下移动①中铜丝可控制SO2的量
B.②中选用品红溶液验证SO2的生成
C.③中选用NaOH溶液吸收多余的SO2
D.为确认CuSO4生成,向①中加水,观察颜色
难度: 困难查看答案及解析
-
将SO2通入CuSO4和NaCl的浓溶液中,溶液颜色变浅,析出白色沉淀,取该沉淀分析,知其中含Cl:35.5%,Cu:64.5%,SO2在上述反应中作用是( )
A.作为酸 B.作为漂白剂 C.作为还原剂 D.作为氧化剂
难度: 困难查看答案及解析
-
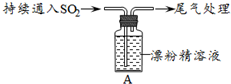
如右图所示,在注射器中加入少量Na2SO3晶体,并吸入少量的浓硫酸(以不接触纸条为准)。则下列有关说法正确的是( )
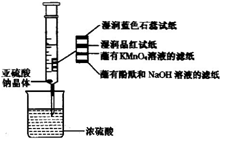
A.蓝色石蕊试纸先变红后褪色
B.沾有KMnO4溶液的滤纸褪色,证明了SO2的漂白性
C.品红试纸褪色,证明了SO2的漂白性
D.沾有酚酞和NaOH溶液的滤纸褪色,证明了SO2的漂白性
难度: 中等查看答案及解析
-
现有一Na2SO3、Na2SO4混合物样品ag,为了测定其中Na2SO3的质量分数,设计了如下方案,其中明显不合理的是( )
A.将样品配制成溶液V1 L,取其中25.00mL恰好与V2 mL浓度为cmol/L酸性KMnO4溶液完全反应
B.向样品中加足量H2O2,再加足量BaCl2溶液,过滤,将沉淀洗涤、干燥,称量其质量为bg
C.将样品与足量稀盐酸充分反应后,再加入足量BaCl2溶液,过滤,将沉淀洗涤、干燥,称量其质量为c g
D.将样品与足量稀盐酸充分反应,生成的气体依次通过盛有饱和NaHSO3的洗气瓶、盛有浓H2SO4的洗气瓶、盛有碱石灰的干燥管Ⅰ、盛有碱石灰的干燥管Ⅱ,测定干燥管Ⅰ增重d g
难度: 困难查看答案及解析
-
将一定量的锌与100mL 18.4mol/L浓硫酸充分反应后,锌完全溶解,同时生成气体A 31.36L(标准状况).将反应后的溶液稀释至1L,测得溶液c(H+)=0.08mol/L,则下列叙述中错误的是( )
A.气体A为SO2和H2的混合物
C.气体A中SO2和H2的体积比为1:4
B.反应中共消耗91gZn
D.反应中共转移2.8mol电子
难度: 困难查看答案及解析