-
在20℃、1个大气压下,将三个分别盛满氨气、氯化氢、二氧化氮的等容积烧瓶分别倒置于盛有水的水槽中,当水进入烧瓶中,并使气体充分溶解后(假设试管中的溶液不向外扩散),三种溶液的物质的量浓度之比为
A.1∶1∶1 B.3∶3∶2 C.1∶2∶3 D.1∶1∶2
难度: 中等查看答案及解析
-
有下列物质,正盐:钾盐、钠盐、铵盐、钡盐;酸:盐酸、硝酸、醋酸、稀硫酸。在水溶液中符合离子方程式:2H++SO32-===SO2↑+H2O的化学反应的组合共有
A.6个 B.9个 C.12个 D.15个
难度: 中等查看答案及解析
-
下列说法不正确的是
①将BaSO4放入水中不能导电,所以BaSO4是非电解质
②氨溶于水得到的氨水能导电,所以氨水是电解质
③固态共价化合物不导电,熔融态的共价化合物可以导电
④固态的离子化合物不导电,熔融态的离子化合物也不导电
⑤强电解质溶液的导电能力一定比弱电解质溶液的导电能力强
A.①④ B.①④⑤ C.①②③④ D.①②③④⑤
难度: 中等查看答案及解析
-
下列有关物质变化和分类的说法正确的是
A.电解熔融态的Al2O3、12C转化为14C都属于化学变化
B.胆矾、冰水混合物、四氧化三铁都不是混合物
C.葡萄糖溶液和淀粉溶液的本质区别是能否发生丁达尔效应
D.SiO2、NO2、Al2O3都属于酸性氧化物
难度: 中等查看答案及解析
-
下列叙述正确的是
A.将5.85 g NaCl晶体溶入100 mL水中,制得0.1 mol/L NaCl溶液
B.将1体积c mol/L硫酸溶液用水稀释为5体积,得到0.2c mol/L硫酸溶液
C.将25 g无水CuSO4溶于水制成100 mL溶液,其浓度为1 mol/L
D.将w g a% NaCl溶液蒸发掉w/2 g水,得到4a%NaCl溶液
难度: 中等查看答案及解析
-
实验中需用2.0 mol/L的Na2CO3溶液950 mL,配制时应选用容量瓶的规格和称取Na2CO3固体的质量分别为
A.950 mL;201.4 g B.1000 mL;212.0 g
C.100 mL;21.2 g D.500 mL;100.7 g
难度: 中等查看答案及解析
-
下列条件中,两种气体所含原子数一定相等的是
A.同质量、不同密度的N2和CO B.同温度、同体积的H2和N2
C.同体积、同密度的C2H6和NO D.同压强、同体积的N2O和CO2
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数,下列说法中正确的是
A.1 mol甲烷的质量与甲烷的摩尔质量相等
B.28 g氮气与40 g氩气所含的原子数目相等,都是NA个
C.2.3 g钠和过量氧气反应,失去的电子数为0.1NA
D.18 g重水(D2O)所含的电子数为10NA
难度: 中等查看答案及解析
-
某溶液中(假定不考虑水解因素)仅含有K+、Mg2+、SO42-、NO3-四种离子,其中K+与Mg2+的个数之比为4∶5,则NO3-与SO42-的物质的量浓度之比一定不是
A.8∶3 B.3∶2 C.2∶3 D.1∶3
难度: 中等查看答案及解析
-
某同学欲配制符合下列条件的溶液,其中可能实现的是
A.只含0.1 mol Na+、0.2 mol Mg2+、0.1 mol Cl-和0.1 mol NO3-的溶液
B.只含0.1 mol NH4+、0.1 mol Ca2+、0.1 mol CO32-和0.1 mol Cl-的溶液
C.为了通过测定pH的大小,达到比较HCl和CH3COOH酸性强弱的目的,分别配制100 mL 0.1 mol/L的NaCl溶液和CH3COONa溶液
D.仅用1 000 mL的容量瓶、烧杯、玻璃棒、量筒、58.5 g NaCl固体和水配制1 L 1 mol/L的NaCl溶液
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式是
A.Fe3O4溶于足量稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O
B.NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O
C.向澄清石灰水中通入少量CO2:OH-+CO2=HCO3-
D.将0.2 mol·L-1的NH4Al(SO4)2溶液与0.3 mol·L-1的Ba(OH)2溶液等体积混合:
2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
难度: 困难查看答案及解析
-
下列有关溶液组成的描述合理的是
A.无色溶液中可能大量存在Al3+、NH4+、Cl-、S2-
B.弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO3-
C.酸性溶液中可能大量存在Na+、ClO-、SO42-、I-
D.中性溶液中可能大量存在Fe3+、K+、Cl-、SO42-
难度: 中等查看答案及解析
-
在一种酸性溶液中,可能存在NO3-、I-、Cl-、Fe3+中的一种或几种离子,向该溶液中加入溴水,溴单质被还原,则以下推测中不正确的是
A.一定有碘离子 B.可能含铁离子
C.可能有氯离子 D.不含硝酸根离子
难度: 中等查看答案及解析
-
已知氧化还原反应:2Cu(IO3)2+24KI+12H2SO4===2CuI↓+13I2+12K2SO4+12H2O
其中1 mol氧化剂在反应中得到的电子为
A.10 mol B.11 mol C.12 mol D.13 mol
难度: 中等查看答案及解析
-
二氯化二硫(S2C12)是广泛用于橡胶工业的硫化剂,其分子结构如图所示。常温下,S2C12是一种橙黄色液体,遇水易水解,并产生能使品红褪色的气体,化学方程式为: 2S2C12+2H2O=SO2↑+3S↓+4HCl。下列说法中错误的是
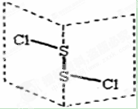
A.S2C12的结构式为Cl—S—S—Cl
B.反应中SO2是还原产物,S是氧化产物
C.S2C12为含有极性键和非极性键的分子
D.反应中,生成1molSO2,转移电子为3mol
难度: 困难查看答案及解析
-
在10ml 0.1mol·L-1NaOH溶液中加入同体积、同浓度HAc溶液,反应后溶液中各微粒的浓度关系错误的是
A.c(Na+)>c(Ac-)>c(H+)>c(OH-) B.c(Na+)>c(Ac-)>c(OH-)>c(H+)
C.c(Na+)=c(Ac-)+c(HAC) D.c(Na+)+c(H+)=c(Ac-)+c(OH-)
难度: 中等查看答案及解析
-
关于铅蓄电池的说法正确的是
A.在放电时,正极发生的反应是Pb(s)+SO42-(aq)-2e-===PbSO4(s)
B.在放电时,该电池的负极材料是铅板
C.在充电时,电池中硫酸的浓度不断变小
D.在充电时,阳极发生的反应是PbSO4(s)+2e-===Pb(s)+SO42-(aq)
难度: 中等查看答案及解析
-
在一定温度下,向饱和的烧碱溶液中放入一定量的过氧化钠,充分反应后恢复到原温,下列说法正确的是
A.溶液中的Na+浓度增大,有O2放出 B.溶液中的OH-浓度不变,有H2放出
C.溶液中的Na+数目减小,有O2放出 D.溶液中的OH-浓度增大,有O2放出
难度: 中等查看答案及解析
-
由氧化铜、氧化铁组成的混合物ag,加入2mol·L-1的硫酸50mL时固体恰好完全溶解。若将ag该混合物在足量的一氧化碳中加热充分反应,冷却后固体质量减少为
A.1.6g B.(a-1.6)g C.(a-3.2)g D.无法计算
难度: 中等查看答案及解析
-
某混合物含有氯化钠、碳酸钠和氯化钾。经分析知其中氯的质量分数为35.5%,则该混合物中碳酸钠的质量分数可能为
A.20% B.30% C.45% D.55%
难度: 中等查看答案及解析
-
将Mg—Cu合金11.2g完全溶解于硝酸中,反应产生的X气体,再向所得溶液中加入NaOH溶液,恰好完全反应时产生21.4g沉淀,根据题意推断X气体的成份可能是
A.0.3molNO
B.0.2molNO2和0.1molN2O4
C.0.1molNO、0.2molNO2和0.05molN2O4
D.0.1molNO、0.1molNO2和0.2molN2O4
难度: 中等查看答案及解析

