-
把V L含有MgS04和K2S04的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为
A.mol·L-1 B. mol·L-1
C. mol·L-1 D. mol·L-1
难度: 简单查看答案及解析
-
下列关于物质的分类均正确的组合是( )
选项
碱
酸
盐
碱性氧化物
酸性氧化物
A
Na2CO3
H2SO4
NaHCO3
SiO2
CO2
B
NaOH
HCl
NaCl
Na2O
CO
C
NaOH
CH3COOH
CaF2
Al2O3
SO2
D
KOH
HNO3
CaCO3
CaO
SO3
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
化学与生活密切相关,下列说法正确的是( )
A. 氢氧化铝胶体可用来对自来水净水和杀菌消毒
B. “血液透析”利用了胶体的性质
C. BaCO3常用来做胃镜中的“钡餐”
D. 为了消除碘缺乏病,在食用盐中加入一定量的碘单质
难度: 简单查看答案及解析
-
下列说法中正确的是( )
A. 1 mol氢的质量是2 g
B. 0.5 mol H2SO4中H2分子的数目是3.01×1023
C. 1 mol水与44 g二氧化碳所含原子数不相等
D. 0.5 mol氧分子约含6.02×1023个氧原子
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法中正确的是
A. 0.2 mol/L CaCl2溶液中含有氯离子的数目为0.4NA
B. 18 g D2O中所含电子数为10NA
C. 2.24 L N2和O2的混合气体中分子数为0.2NA
D. 标准状况下,33.6 L SO3中含有氧原子的数目大于4.5NA
难度: 简单查看答案及解析
-
下列组合属于同位素的是( )
A. 金刚石和石墨 B. 16O和18O C. 水和重水 D. 氧气和臭氧
难度: 简单查看答案及解析
-
下列说法中正确的是( )
A. 40 g NaOH溶于1 L水,形成1 mol/L的溶液
B. 氧气的摩尔质量等于它的相对分子质量
C. 同温同压下,相同体积的CO和水所含的分子数可能相同
D. 质量相同但密度不同的氮气和C2H4(乙烯)所含的分子数不同
难度: 简单查看答案及解析
-
下列电离方程式书写正确的是( )
A. H2CO3
CO32-+2H+ B. KClO3=K++Cl5++3O2-
C. H2O
2H++O2- D. NH3·H2O
NH4++OH-
难度: 简单查看答案及解析
-
某溶液中含有大量的下列离子:Fe3+、SO42-、Al3+和M离子。经测定Fe3+、SO42-、Al3+和M离子的物质的量浓度之比为1:4:1:2,则M离子可能是下列中的( )
A. Cl- B. OH- C. Na+ D. Ag+
难度: 简单查看答案及解析
-
下列溶液里离子检验的结论正确的是
A. 加稀盐酸产生无色无味气体,将气体通入澄清石灰水,石灰水变浑浊,原溶液可能 含 CO32-
B. 加入 BaCl2 溶液有白色沉淀产生,再加盐酸,沉淀不消失,原溶液一定含有 SO42-
C. 加入 AgNO3 溶液有白色沉淀产生,原溶液一定含有 Cl-
D. 加入 Na2CO3 溶液有白色沉淀产生,再加盐酸,白色沉淀消失,原溶液中一定含有 Ca2+
难度: 简单查看答案及解析
-
胶体区别于其它分散系的本质特征为
A. 分散质直径介于1~100 nm B. 丁达尔效应
C. 电泳现象 D. 能发生聚沉
难度: 简单查看答案及解析
-
某密闭容器盛装一氧化碳和二氧化碳气体,容积为22.4 L,此时温度为273 K,容器内压强为1个大气压,混合气相对于氢气的密度为15,则该容器中CO的质量为
A. 5.5 g B. 24.5 g C. 28 g D. 30 g
难度: 简单查看答案及解析
-
下列实验操作,正确的是
A. 各放一张质量相同的称量纸于托盘天平的托盘上,将NaOH固体放在左盘称量4.0 g
B. 制Fe(OH)3胶体时,将FeCl3溶液加入到沸水中,在加热煮沸一段时间
C. 做蒸发实验时,可将蒸发皿中溶液蒸干得固体
D. 蒸馏实验忘记加入沸石,应停止加热,冷却至室温再补加
难度: 简单查看答案及解析
-
CS2(液体)能在氧气中燃烧生成CO2和SO2,将0.228 g CS2 在448 mL(标准状况) O2中燃烧,将燃烧后的混合气体恢复到标况时体积为
A. 201.6 mL B. 448 mL C. 224 mL D. 336 mL
难度: 简单查看答案及解析
-
标准状况下,有以下三种物质:①18 g H2O;②11.2 L H2S气体;③0.5 mol C2H5OH(酒精)。下列排列顺序正确的是
A. 密度:①>③>② B. 体积:①>③>②
C. 质量:③>②>① D. 氢原子数:①>②>③
难度: 简单查看答案及解析
-
X、Y-、Z+三种微粒的电子层结构相同,则一定不可能再相等的是
A. 中子数 B. 质量数 C. 核电荷数 D. 电子数
难度: 简单查看答案及解析
-
将15 mL 2 mol·L-1 Na2CO3溶液逐滴加入到40 mL 0.5 mol·L-1 MCln盐溶液中,恰好将溶液中的Mn+离子完全沉淀为碳酸盐,则MCln中n值是
A.4 B.3 C.2 D.1
难度: 中等查看答案及解析
-
在密闭气缸中用一不漏气的可自由移动的活塞隔开(如下图),右边充有H2和O2,左边充有N2,在20℃时将右边的混合气体点燃,冷却到原温度。若活塞原来距离气缸左端的距离为总长的1/4,反应后活塞静止于气缸中点(水的体积忽略不计),则原来H2和O2的体积比可能为( )
A. 2:1 B. 7:2 C. 5:4 D. 8:1
难度: 简单查看答案及解析
-
现有四组分散系:①汽油和水形成的乳浊液;②含有泥沙的食盐水;③溶有碘(I2)的酒精溶液;④乙二醇和丙三醇的混合溶液(乙二醇和丙三醇的部分物理性质见下表)。
物质
熔点/℃
沸点/℃
密度/g·cm-3
溶解性
乙二醇
-11.5
198
1.11
易溶于水和乙醇
丙三醇
17.9
290
1.26
能跟水、酒精以任意比互溶
请用下图所示的仪器分离以上各混合液,仪器和方法不能对应的是( )
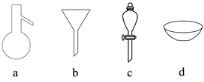
A. ①―c―分液 B. ②―b―过滤 C. ③―d―蒸发结晶 D. ④―a―蒸馏
难度: 简单查看答案及解析
-
标准状况下,将V L HCl气体溶解在1 L水(水的密度为1 g/cm3)中,形成饱和溶液,所得溶液的密度为ρ g/mL,质量分数为ω,物质的量浓度为c mol/L,溶解度为s g,下列关系式不正确的是( )
A. c=1000Vρ/(36.5V+22400) B. ω=36.5V/(36.5V+22400)
C. ρ=(36.5V+22400)/(22.4+22.4V) D. s=36.5V/224
难度: 简单查看答案及解析