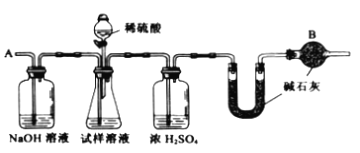
-
下列所列物质,贴错了危险警告标签的是
选项
A
B
C
D
物质
浓硫酸
四氯化碳
氰化钾
黑火药
标签

腐蚀品

易燃气体

剧毒品

爆炸品
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列关于物质分类的说法正确的是
A. SO2和CO2都能和碱溶液反应,均属于酸性氧化物
B. 醋酸、纯碱和生石灰分别属于酸、碱、氧化物
C. 盐酸属于混合物,而液氯、浓硫酸均属于纯净物
D. 酸性氧化物一定是非金属氧化物
难度: 简单查看答案及解析
-
下列说正确的是
A. 物质的量就是1摩尔物质的质量 B. 1mol水中含有2mol氢和1mol氧
C. 摩尔是国际科学界建议采用的一种物理量 D. 3molO2与2molH2O所含原子数相等
难度: 简单查看答案及解析
-
下表中物质的分类组合完全正确
选项
A
B
C
D
强电解质
KNO3
H2SO4
BaSO4
HClO4
弱电解质
HF
CaCO3
H2SO3
CH3COONH4
非电解质
SO3
Al
H2O
C2H5OH
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
对于等质量的下列气体中,含有的分子个数最多的是
A. Cl2 B. H2 C. O2 D. CO
难度: 中等查看答案及解析
-
下列物质的分离方法中,主要是利用密度不同达到分离目的的是
A. 把石油蒸馏分离成汽油、煤油和柴油等
B. 煎中药时用水在煮沸条件下提取中药的有效成分
C. 把大豆磨碎后,用水溶解其中可溶性成分,经过滤后,分成豆浆和豆渣
D. 做饭洗米时淘去米中的沙
难度: 中等查看答案及解析
-
要尽量除去杂质,加入的试剂必须稍过量,最后的过量物可以使用物理或化学方法除去。要除去NaCl中少量的CaCl2、Na2SO4杂质,下列试剂及使用顺序正确的是
A. Na2CO3、BaCl2、HCl
B. BaCl2、Na2CO3、H2SO4
C. BaCl2、Na2CO3、HCl
D. Ba(NO3)2、Na2CO3、HCl
难度: 简单查看答案及解析
-
对下列未知盐的稀溶液所含离子的检验中,作出的判断一定正确的是
A. 先加入氯化钡溶液时不产生沉淀,继续加入硝酸银溶液时,有不溶于稀硝酸的白色沉淀生成,可判定含有Cl—
B. 先加稀盐酸酸化时没有现象,再加入氯化钡溶液有白色沉淀生成,可判定含有SO42-
C. 加入NaOH溶液,有白色沉淀产生,可判定含有Mg2+
D. 加入盐酸后有无色无味气体逸出,此气体能使澄清石灰水变浑浊,判定一定含有CO32-
难度: 中等查看答案及解析
-
下列与安全有关的说法正确的是
A. 碘是人体必需微量元素,所以要多吃富含高碘酸的食物
B. 易燃试剂与强氧化性试剂分开放置并远离火源
C. 浓H2SO4溅到皮肤上,立即用碳酸钠稀溶液洗涤
D. 氢氧化钠浓溶液溅入眼中,应立即用大量水冲洗,再用稀盐酸冲洗
难度: 中等查看答案及解析
-
下列有关胶体的叙述中不正确的是
A. 实验室可用丁达尔效应鉴别胶体与溶液
B. “雨后彩虹”既是一种自然现象又是光学现象,同时也与胶体有关
C. 1 mol Fe3+完全反应生成氢氧化铁胶体粒子的数目为NA
D. 分散质粒子大小介于1 nm~100 nm之间的分散系称为胶体
难度: 简单查看答案及解析
-
在无色透明的酸性溶液中,能大量共存的离子组是
A. Al3+、Ag+、NO3-、Cl- B. Mg2+、NH4+、NO3-、Cl-
C. K+、CO32-、Cl-、Na+ D. Na+、OH-、SO42-、Fe2+
难度: 中等查看答案及解析
-
下列变化需要加入还原剂才能实现的是
A. CO32—→CO2 B. Cl—→Cl2 C. Cr2O72—→Cr3+ D. NH3→NO
难度: 中等查看答案及解析
-
某铁的氧化物中铁元素和氧元素的质量比为21∶8,该氧化物的化学式可能是
A. FeO B. Fe2O3 C. Fe3O4 D. Fe4O5
难度: 中等查看答案及解析
-
标准状况下有①6.72LCH4 ②3.01×1023个HCl ③13.6gH2S ④0.2molNH3。下列对这四种气体的关系从小到大表示不正确的是
A. 体积:④<①<②<③ B. 密度:①<④<③<②
C. 质量:④<①<③<② D. 氢原子数:②<④<③<①
难度: 中等查看答案及解析
-
在反应8NH3+3Cl2=6NH4Cl+N2中,氧化剂和还原剂的物质的量之比为
A. 1:6 B. 3:8 C. 2:3 D. 3:2
难度: 中等查看答案及解析
-
下列说法中错误的是
A. 从1L1mol·L-1的NaCl溶液中取出10mL,其浓度仍是1mol·L-1
B. 制备0.5L 10mol·L-1的盐酸,需要氯化氢气体112L(标准状况)
C. 0.5L 2mol·L-1BaCl2溶液中,Ba2+和Cl-总数为3×6.02×1023
D. 10mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数为9.8%
难度: 中等查看答案及解析
-
科学家刚刚发现了某种元素的原子,1个该原子质量是a g,一个12C原子质量是b g,NA是阿伏加德罗常数的值,下列说法正确的是
①该原子的相对原子质量为12a/b ②m g该原子的物质的量为 m/aNAmol
③该原子的摩尔质量是aNA g ④Wg该原子中含有W/a个该原子
⑤由已知信息可得:NA=12/a
A. ①②④ B. ①③ C. ②③ D. ③⑤
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法中正确的是
A. 2.4g金属镁变为镁离子时失去的电子数为0.2NA
B. 常温常压下,11.2L C2H4含有2NA个碳原子
C. 标准状况下,11.2LCCl4含有的分子数为0.5NA
D. 常温常压下,32gO2和O3的混合气体所含原子数为2.5NA
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A. 碳酸钡与盐酸反应: 2H+ + BaCO3= Ba2+ + H2O + CO2↑
B. 氢氧化钡溶液与稀硫酸混合: Ba2+ + SO42-+ H++ OH-= BaSO4↓+ H2O
C. 醋酸与氢氧化钠溶液混合: H+ + OH-= H2O
D. CO2通入过量的澄清石灰水中:CO2 + Ca(OH)2 = CaCO3↓+ H2O
难度: 中等查看答案及解析
-
在标准状况下,18gCO和CO2的混合气体的物质的量为0.5mol,则此混合气体中CO和CO2的物质的量之比是
A. 1:1 B. 1:7 C. 1:11 D. 7:11
难度: 困难查看答案及解析
-
下列实验装置设计正确且能达到目的的是
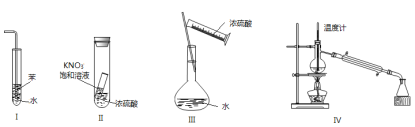
A. 实验Ⅰ:可用于吸收氨气,并能防止倒吸(氨气极易溶于水)
B. 实验Ⅱ:静置一段时间,小试管内饱和硝酸钾溶液中有晶体析出
C. 实验Ⅲ:配制一定物质的量浓度的稀硫酸
D. 实验Ⅳ:可用于对石油的分馏
难度: 中等查看答案及解析
-
在相同状况下,一个空瓶若装满O2称其质量为36g,若装满CO2称其质量为42g,若装满A气体,称其质量为52 g,则A的相对分子质量是
A. 16 B. 32 C. 96 D. 64
难度: 困难查看答案及解析
-
已知A=2B+C+D,其中A的相对分子质量为96,所得产物均为气体,则完全反应后气体混合物密度是相同条件下氢气密度的
A. 10倍 B. 24倍 C. 12倍 D. 48倍
难度: 中等查看答案及解析
-
已知硫酸的密度大于纯水,若以w1和w2分别表示浓度为c1mol/L和c2mol/L硫酸的质量分数,已知2w1=w2,则下列推断正确的是
A. 2c1=c2 B. 2c2=c1 C. c2>2c1 D. c1<c2<2c1
难度: 困难查看答案及解析
-
将标准状况下,将VL A气体(摩尔质量为Mg/mol)溶于0.1L水中,所得溶液密度为ρg/cm3,则此溶液的物质的量浓度(mol/L)为
A. Vρ/(MV+2240)
B. 1000Vρ/(MV+2240)
C. MV/(22.4(V+0.1) ρ
D. 1000VρM/(MV+2240)
难度: 中等查看答案及解析