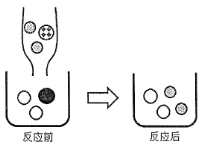
-
生产下列物品所用的主要材料中不属于有机合成材料的是
A. 汽车轮胎 B. 台灯塑料底座 C. 不锈钢水龙头 D. 有机玻璃标牌
难度: 简单查看答案及解析
-
下列关于空气的说法正确的是
A. 空气的主要成分是氮气和氧气
B. 空气中的二氧化碳会造成酸雨
C. 空气中的PM2.5 含量高说明空气质量好
D. 洁净的空气是纯净物
难度: 简单查看答案及解析
-
下列属于物理变化的是
A. 铜在潮湿空气里生成铜绿
B. 用食醋去除水垢
C. 从铝土矿(主要成分是 Al2O3) 中提炼金属铝
D. 用汽油除去衣服上的油污
难度: 简单查看答案及解析
-
下列分类正确的是
选项
物质
类别
A
天然气、乙醇、煤
化石燃料
B
NH3•H2O、NaCl、KNO3
盐
C
焊锡、生铁、钢
混合物
D
空气、石油、甲烧
混合物
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列有关水的说法中,不正确的是
A. 常用肥皂水来鉴别硬水和软水
B. 电解水中负极得到的氧气与正极得到的氢气的体积比为1:2
C. 活性炭净水器里,活性炭的作用是吸附,并过滤水中的不溶性杂质
D. 可用蒸馏的方法将自来水进一步净化
难度: 简单查看答案及解析
-
下列描述与事实不符的是
A. 铁制品生锈产生的铁锈是一种疏松多孔的物质,它的主要成分是Fe3O4
B. 金属钠可以在氧气中燃烧
C. 木炭与氧化铜反应的实验中,体现木炭具有还原性
D. 在日常生活中,大量使用的常常不是纯金属,而是它们的合金
难度: 简单查看答案及解析
-
碱溶液中都含OH-, 因此不同的碱表现出一些共同的性质。下列关于 Ba(OH)2性质的描述中不属于碱的共同性质的是
A. 能与酸反应生成盐和水
B. 能使紫色石蕊溶液变蓝色
C. 能与CO2反应生成H2O
D. 能与 Na2SO4 溶液反应生成 BaSO4 沉淀
难度: 简单查看答案及解析
-
在配制氯化钠溶液过程中,可能导致溶质质量分数偏高的是
A. 称量过程中砝码和氯化钠放反了托盘
B. 装瓶时有少量溶液溅出
C. 溶解过程中有少量水溅出
D. 量筒量取水的体积时采用仰视读数
难度: 简单查看答案及解析
-
用相关知识解释下列现象,其中正确的是
A. 常温下,混合气体A中含有2种化合物, A 在氧气中燃烧后的产物能使澄清石灰水变浑浊, 则 A 中可能含有氢元素和氧元素
B. 浓盐酸和浓硫酸敞口久置千空气中pH值均变大, 原因都是因为溶质挥发所导致
C. 检查实验装置的气密性时,经常利用到“热胀冷缩”原理,原因为分子体积大小发生了改变
D. 由于碳原子的排列方式不同,所以金刚石和石墨的硬度不同,两者的化学性质也不同
难度: 简单查看答案及解析
-
有四种物质的溶液:① Ba(OH)2 ②Na2SO4 ③CuSO4 ④HNO3 不用其他试剂就可以将它们逐一鉴别出来,其鉴别顺序是
A. ④③②① B. ③①②④ C. ①③④② D. ①④②③
难度: 中等查看答案及解析
-
氢氧化钻[CO (OH)2]受热易分解,能与酸性溶液反应, 可作涂料和清漆的干燥剂, 制备方法为:① Co+2HCl=COCl2+H2↑②COCl2+2NaOH=Co(OH)2↓+2NaCl下列判断正确的是
A. 钴的金属活动性比铜的弱 B. 可以利用氢氧化钴干燥氯化氢气体
C. 氢氧化钴的化学性质稳定 D. ①为置换反应,②为复分解反应
难度: 简单查看答案及解析
-
化学肥料和农药对农业的高产丰收具有重要作用。下列有关说法错误的是
A. KNO3 是复合肥料
B. 化肥能提高粮食产量,施用越多越好
C. 熟石灰可以用于改良酸性土壤
D. 铵态氮肥与熟石灰混合研磨后能嗅到刺激性气味
难度: 简单查看答案及解析
-
下列实验中无明显现象的是
A. 向 Mg(NO3)2 溶液中滴加 Na2SO4 溶液
B. 氧化铁与稀盐酸反应
C. 盐酸和碳酸氢钠溶液混合
D. 铜丝与硝酸银溶液反应
难度: 简单查看答案及解析
-
下列除杂所选用试剂与操作方法均正确的是
选项
物质(括号内为杂质)
除杂试剂
实验操作
A
CaO (CaCO3)
水
溶解、过滤
B
KCl固体 ( KClO3 )
少量二氧化猛
加热
C
NaOH 溶液(Na2CO3)
稀盐酸
加入稀盐酸至不再产生气泡
D
CO(CO2)
氢氧化钠
先通过足量的氢氧化钠溶液, 再通过浓硫酸干燥
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
通过下列实验操作和现象能得出正确结论的是
实验操作
现象
结论
A
向 H2O2 溶液中加入少量 MnO2 粉末
产生大量气体
MnO2 是该反应的催化剂
B
50℃时, 将 17g KCI 固体加入50g蒸馏水中,完全溶解后缓慢降温
降温至20℃时开始有晶体析出
20℃ 时, KCl 的溶解度为 17g
C
往久置于空气中的氢氧化钠溶液滴加稀硫酸
有气泡
氢氧化钠溶液已变质
D
在某无色溶液中滴加氯化钡溶液
有白色沉淀
无色溶液中一定含有SO42-
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
乙硫醇(化学式为 C2H6S) 易挥发, 有蒜臭味, 人对该气味极其敏感。下列有关乙硫醇的说法不正确的是
A. 乙硫醇在空气中燃烧后的产物中可能含有SO2
B. 乙硫醇中C、H、S 三种元素的质量比是 2:6:1
C. 硫元素的质量分数是
D. 在管道煤气中添加微量乙硫醇,目的是及时发现煤气泄漏
难度: 简单查看答案及解析
-
硒 Se可以用作光敏材料、电解锰行业催化剂、动物体必需的营养元素和植物有益的营养元素等。其在周期表中的信息及原子结构示意图如图所示。下列对于硒的说法错误是
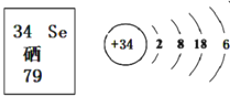
A. 硒与氢元素形成的化合物化学式为H2Se
B. 硒的相对原子质量是79
C. 硒在反应中易失电子
D. 硒的化学性质与硫相似
难度: 简单查看答案及解析
-
下列验证实验不能成功的是( )
A.
 CO2能与烧碱溶液反应
CO2能与烧碱溶液反应B.
 不同物质的着火点不同
不同物质的着火点不同C.
 分子在不断运动
分子在不断运动D.
 质量守恒定律
质量守恒定律难度: 中等查看答案及解析
-
向盛有稀盐酸的烧杯中逐滴加入NaOH 溶液, 测得烧杯中溶液的pH 变化如图所示, 下列说法正确的是

A. a 点所示的溶液中含有的溶质是NaOH和NaCl
B. a、b、c 所示的溶液中都含有Na+、Cl-
C. c 点表示 NaOH 和稀盐酸恰好完全反应
D. b 点所示的溶液中Na+与Cl-个数不相等
难度: 简单查看答案及解析
-
a、b 两种物质的溶解度曲线如图所示。下列说法不正确的是
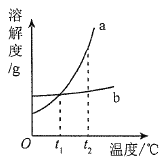
A. 将t2℃时a的饱和溶液降温至t1℃,溶液质量不变
B. 将t1℃时b 的饱和溶液加水可变为不饱和溶液
C. 将t2℃时 a、b 的饱和溶液分别降温至t1℃两溶液的溶质质量分数相等
D. 除去 a 固体中的少量b 杂质的方法为: 加水溶解, 蒸发浓缩,冷却结晶,过滤,洗涤,干燥。
难度: 简单查看答案及解析