-
下列叙述中,正确的是
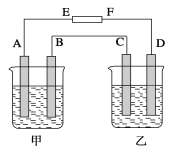
①电解池是将化学能转变成电能的装置
②原电池是将电能转变成化学能的装置
③金属和石墨导电均为物理变化,电解质溶液导电是化学变化
④不能自发进行的氧化还原反应,通过电解的原理有可能实现
⑤电镀过程相当于金属的“迁移”,可视为物理变化
A. ①②③④ B. ③④
C. ③④⑤ D. ④
难度: 简单查看答案及解析
-
有A、B、C、D、E五块金属片,进行如下实验:①A、B用导线相连后,同时浸入稀H2SO4溶液中,A极为负极;②C、D用导线相连后,同时浸入稀H2SO4溶液中,电流由D→导线→C;③A、C相连后,同时浸入稀H2SO4溶液中,C极产生大量气泡;④B、D相连后,同时浸入稀H2SO4溶液中,D极发生氧化反应;⑤用惰性电极电解含B离子和E离子的溶液,E先析出。据此,判断五种金属的活动性顺序是
A. A>B>C>D>E B. A>C>D>B>E
C. C>A>B>D>E D. B>D>C>A>E
难度: 中等查看答案及解析
-
下列情况下的反应一定能自发进行的是( )
A. ΔH>0,ΔS<0 B. ΔH>0,ΔS>0
C. ΔH<0,ΔS>0 D. ΔH<0,ΔS<0
难度: 简单查看答案及解析
-
下列有关电子云的叙述中,正确的是( )
A. 电子云形象地表示了电子在核外某处单位体积内出现的概率
B. 电子云直观地表示了核外电子的数目
C. 1s电子云界面图是一个球面,表示在这个球面以外,电子出现的概率为零
D. 电子云是电子绕核运动形成了一团带负电荷的云雾
难度: 中等查看答案及解析
-
能说明醋酸是弱电解质的事实是( )
A. 醋酸水溶液能使湿润的蓝色石蕊试纸变红
B. 醋酸和碳酸钠溶液反应放出二氧化碳
C. c(H+)相同的醋酸和盐酸相比较,醋酸溶液的浓度大
D. 浓度和体积均相同的醋酸和盐酸可中和等物质的量的NaOH
难度: 中等查看答案及解析
-
元素的性质呈现周期性变化的根本原因是( )
A. 原子半径呈周期性变化
B. 元素的化合价呈周期性变化
C. 第一电离能呈周期性变化
D. 元素原子的核外电子排布呈周期性变化
难度: 简单查看答案及解析
-
下列各组指定的元素,不能形成AB2型化合物的是( )
A. 2s22p2和2s22p4 B. 3s23p4和2s22p2
C. 3s2和3s23p5 D. 3s1和3s23p5
难度: 中等查看答案及解析
-
物质的量浓度相同的下列溶液中,NH4+浓度最大的是( )
A. NH4Cl B. NH4HSO4 C. CH3COONH4 D. NH3·H2O
难度: 中等查看答案及解析
-
下列各组元素,按原子半径依次减小,元素第一电离能逐渐增大的顺序排列的是( )
A. K、Na、Li B. Al、Mg、Na C. N、O、C D. Cl、S、P
难度: 中等查看答案及解析
-
一定温度下, 向aL的密闭容器中加入2molNO2(g), 发生如下反应:2NO2
2NO+O2, 此反应达到平衡的标志是 ( )
A. 单位时间内生成2nmolNO同时生成2nmolNO2
B. 混合气体中NO2、NO和O2的物质的量之比为2:2:1
C. 单位时间内生成2nmolNO同时生成nmolO2
D. 混合气体的颜色变浅
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 原子核外电子排布式为1s2的原子与核外电子排布式为1s22s2的原子化学性质相似
B. Fe3+的最外层电子排布式为3s23p63d5
C. 基态铜原子的最外层的电子排布图:

D. 基态碳原子的最外层电子排布图:
难度: 中等查看答案及解析
-
下列关于能层与能级的说法中正确的是( )
A. 原子核外电子的每一个能层最多可容纳的电子数为2n2
B. 任一能层的能级总是从s能级开始,而且能级数少于该能层的能层序数
C. 同是s能级,在不同的能层中所能容纳的最多电子数是不相同的
D. 1个原子轨道里最多只能容纳2个电子,但自旋方向相同
难度: 中等查看答案及解析
-
反应2A(g)
2B(g)+E(g)(正反应为吸热反应)达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是
A. 加压 B. 减压 C. 减少E的浓度 D. 降温
难度: 中等查看答案及解析
-
在密闭容器中进行如下反应:X2(g)+Y2(g)
2Z(g),在温度T1和T2时,产物的量与反应时间的关系如图所示.符合图示的正确判断是( )
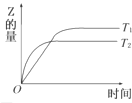
A. T1<T2,正反应是放热反应 B. T1<T2,正反应是吸热反应
C. T1>T2,正反应是放热反应 D. T1>T2,正反应是吸热反应
难度: 中等查看答案及解析
-
在一个固定体积的密闭容器中,加入2molA和1molB,发生反应:2A(气) + B(气)
3C(气) + D(气)达到平衡时,C的浓度为W mol/L,若维持容器体积和温度不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍为W mol/L的是 ( )
A. 4molA+2molB B. 2molA+1molB+3molC+1molD
C. 3molC+1molD+1molB D. 3molC+1molD
难度: 困难查看答案及解析
-
温度一定时, 于密闭容器中发生可逆反应: mA(气) + nB(气)
pC(气), 达到平衡后, 若将混合气体的体积压缩到原来的 1/2, 当再次达到平衡时, C的浓度为原平衡时C的浓度的 1.9倍, 则下列叙述中正确的是( )
A. 平衡向逆反应方向移动 B. C气体的体积分数增大
C. 气体A的转化率升高 D. m + n > p
难度: 困难查看答案及解析
-
下列金属防腐的措施中,使用外加电流的阴极保护法的是( )
A. 水中的钢闸门连接电源的负极 B. 金属护栏表面涂漆
C. 汽水底盘喷涂高分子膜 D. 地下钢管连接镁块
难度: 简单查看答案及解析
-
下列各方程式中,属于水解反应的是( )
A. HCO3—+H2O
H2CO3+OH- B. HCO3—+H2O
CO32—+H3O+
C. HCO3—+OH-=CO32-+H2O D. CO32-+H+=HCO3—
难度: 简单查看答案及解析
-
无色透明溶液中能大量共存的离子组是( )
A. Na+、Al3+、HCO3-、NO3- B. AlO2-、Cl-、Mg2+、K+
C. NH4+、Na+、CH3COO-、NO3- D. Na+、NO3-、ClO-、I-
难度: 中等查看答案及解析
-
已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16,Ksp(Ag2CrO4)=2.0×10-12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是( )
A. AgCl>AgI>Ag2CrO4 B. AgCl>Ag2CrO4>AgI
C. Ag2CrO4>AgCl>AgI D. Ag2CrO4>AgI>AgCl
难度: 中等查看答案及解析