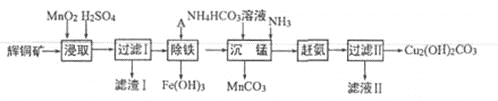
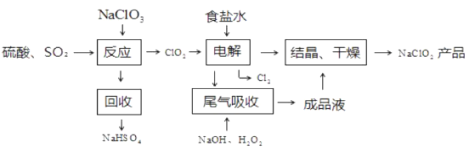
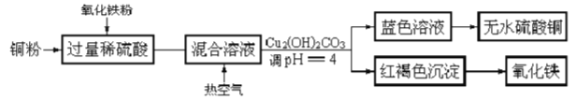
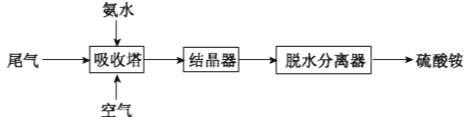
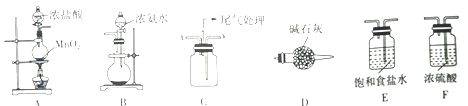
-
有些科学家提出硅是“21世纪的能源”,下列有关硅及其化合物的说法正确的是
A. 硅在自然界中以游离态和化合态两种形式存在
B. 硅晶体是良好的半导体,可用于制造光导纤维
C. SiO2是酸性氧化物,不与任何酸发生反应
D. 木材浸过水玻璃后,不易着火
难度: 简单查看答案及解析
-
下列有关二氧化硫的说法正确的是( )
A. SO2能使酸性高锰酸钾溶液褪色,说明SO2具有漂白性
B. SO2是一种无色无味且较易溶于水的气体
C. SO2具有漂白作用,但SO2不能用于银耳等食品的漂白
D. SO2与Cl2按体积比1:1的混合气体对红色鲜花的漂白效果比单独用氯气的漂白效果更好
难度: 简单查看答案及解析
-
下列有关物质用途的说法中,不正确的是( )
A. 二氧化硅是目前人类将太阳能转换为电能的常用材料
B. 氧化铝是冶炼金属铝的原料,也是一种比较好的耐火材料
C. 过氧化钠可用于呼吸面具或潜水艇中作为氧气的来源
D. 三氧化二铁常用作红色油漆和涂料
难度: 简单查看答案及解析
-
化学与生产、生活密切相关.下列有关叙述正确的是( )
A. 大气雾霾污染现象的产生与汽车尾气排放有关
B. 玻璃和氮化硅陶瓷都属于新型无机非金属材料
C. 活性炭与二氧化硫都可用于漂白,其漂白原理相同
D. 空气中的臭氧对人体健康有益无害
难度: 简单查看答案及解析
-
《青花瓷》中所描述的“瓶身描述的牡丹一如你初妆”“色白花青的锦鲤跃然于碗底”等图案让人赏心悦目,但古瓷中所用颜料成分一直是个谜,近年来科学家才得知大多为硅酸盐,如蓝紫色的硅酸铜钡(BaCuSi2Ox,铜为十2价),下列有关硅酸铜钡的说法不正确的是( )
A. 可用氧化物形式表示为BaO·CuO·2SiO2 B. 易溶解于强酸和强碱
C. 性质稳定.不易脱色 D. x=6
难度: 中等查看答案及解析
-
由二氧化硅制高纯硅的流程如下,下列判断中错误的是( )
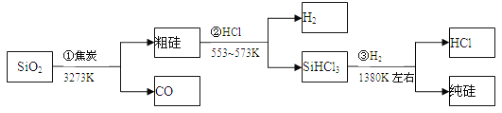
A. ①②③均属于氧化还原反应 B. H2和HCl均可循环利用
C. SiO2是一种坚硬难熔的固体 D. SiHCl3摩尔质量为135.5 g
难度: 中等查看答案及解析
-
下列关于氯水的叙述中,正确的是
A. 1mol氯气溶于水转移电子数为1NA
B. 新制氯水在光照的条件下,可以产生气体,该气体是氯气
C. 新制氯水中滴加硝酸银溶液,没有任何现象
D. 新制氯水可以使干燥的布条褪色
难度: 简单查看答案及解析
-
如图是用于干燥、收集并吸收多余气体的装置,下列方案正确的是( )
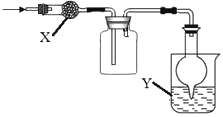
选项
X
收集气体
Y
A
碱石灰
氯气
氢氧化钠
B
碱石灰
氯化氢
氢氧化钠
C
氯化钙
二氧化硫
氢氧化钠
D
氯化钙
一氧化氮
氢氧化钠
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
某溶液中可能含有K+、Na+、Fe3+、Fe2+、SO42﹣、CO32﹣、I﹣、Cl﹣中的一种或多种,进行如图所示的实验,下列说法正确的是( )
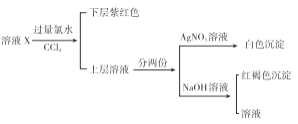
A. 溶液X中有Fe3+、SO42﹣
B. 溶液X中有Fe2+、I﹣可能有SO42﹣、Cl﹣
C. 溶液X中有I﹣、Cl﹣,无CO32﹣
D. 溶液X中有I﹣,Fe2+和Fe3+两种离子中至少有一种
难度: 困难查看答案及解析
-
25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
A. 在强碱性溶液中:Na+、K+、AlO2﹣、Cl﹣
B. pH=l的溶液中:HCO3﹣、NH4+、NO3﹣、Ca2+
C. 无色溶液中:Cu2+、NO3﹣、Cl﹣、H+
D. 无色溶液中:Na+、K+、ClO﹣、SO32﹣
难度: 中等查看答案及解析
-
下列实验报告记录的实验现象正确的是( )
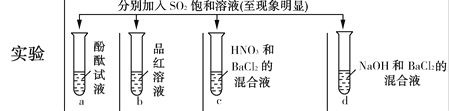
A
无色
无色
无现象
无色溶液
B
红色
无色
白色沉淀
白色沉淀
C
无色
无色
白色沉淀
白色沉淀
D
无色
无色
无色溶液
无色溶液
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
现有等体积混合而成的四组气体:①NO2+NO; ②NO2+O2;③HCl+N2;④NO+N2,将其分别通入体积相同的试管,并立即倒立于水槽中,试管内水面上升的高度分别为H1,H2,H3,H4,其中高度关系是( )
A. H2>H3>H1>H4 B. H3>H2>H1>H4 C. H1=H2=H3=H4 D. H1>H2>H3>H4
难度: 中等查看答案及解析
-
已知NO2、NO的混合气体可与NaOH溶液发生化学反应:2NO2+2NaOH===NaNO2+NaNO3+H2O NO+NO2+2NaOH===2NaNO2+H2O将224 mL(标准状况下)NO和NO2的混合气体溶于20 mL NaOH溶液中,恰好完全反应并无气体逸出。则NaOH溶液的物质的量浓度为 ( )
A. 1 mol/L B. 0.5 mol/L C. 0.25 mol/L D. 0.2 mol/L
难度: 困难查看答案及解析
-
某混合气体中可能含有Cl2、O2、SO2、NO、NO2中的两种或多种气体。现将此无色透明的混合气体通过品红溶液后,品红溶液褪色,把剩余气体排入空气中,很快变为红棕色。对于原混合气体成分的判断中正确的是 ( )
A. 肯定只有SO2 B. 肯定没有Cl2、O2和NO2
C. 可能有Cl2和O2 D. 肯定只有NO
难度: 中等查看答案及解析
-
对3NO2+H2O===2HNO3+NO反应的下列说法正确的是
A. 氧化剂与还原剂的质量比为1∶2
B. 氧化产物与还原产物的物质的量之比为1∶2
C. NO2是氧化剂,H2O是还原剂
D. 在反应中若有6 mol NO2参与反应时,有3 mol电子发生转移
难度: 简单查看答案及解析
-
下列现象或事实不能用同一原理解释的是( )
A. 浓硝酸和氯水用棕色细口试剂瓶保存
B. 硫化钠和亚硫酸钠固体长期暴露在空气中变质
C. Cl2和SO2都能使品红溶液褪色
D. SO2和FeSO4溶液都能使KMnO4溶液褪色
难度: 中等查看答案及解析
-
下列离子方程式中正确的是( )
A. H2SO4与 Ba(OH)2溶液反应:Ba2++OH﹣+H++SO42﹣═BaSO4↓+H2O
B. Ca(HCO3)2与过量 NaOH 溶液反应:Ca2++HCO3﹣+OH﹣═CaCO3↓+H2O
C. Na2CO3溶液中通入少量 CO2:CO32﹣+CO2+H2O═2HCO3﹣
D. CH3COOH 溶液与 NaOH 溶液反应:H++OH﹣═H2O
难度: 中等查看答案及解析
-
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间的转化关系如下图所示(反应条件己略去)。下列有关物质的推断正确的是
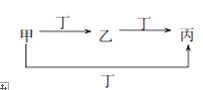
甲
乙
丙
丁
A
N2
NO
NO2
O2
B
SO32-
HSO3-
SO2
H+
C
Cl2
FeCl3
FeCl2
Fe
D
Al3+
Al(OH)3
AlO2-
NH3 .H2O
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
一种无色气体100mL,由NH3、NO、CO2所组成,将此无色气体通过浓硫酸的洗气瓶后,发现气体减少了30mL。剩余气体继续通过Na2O2固体后,发现气体变成红棕色,再将该气体通入盛满水倒立于水槽中的试管内,发现试管内水位上升,最后试管内充满液体。则原混合气体中NH3、NO、CO2气体的体积比为( )
A. 5∶8∶12 B. 15∶14∶21 C. 10∶14∶21 D. 30∶28∶23
难度: 困难查看答案及解析
-
下图是用点滴板探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水后,立即用培养皿罩住整个点滴板。下列对实验现象的解释正确的是( )
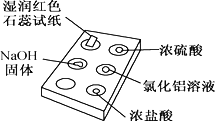
选项
实验现象
解释
A
红色石蕊试纸变蓝
NH3极易溶于水
B
浓硫酸附近无白烟
NH3与浓硫酸不发生反应
C
氯化铝溶液变浑浊
NH3与AlCl3溶液反应:Al3++3OH-=Al(OH)3↓
D
浓盐酸附近有白烟
NH3与挥发出的HCl反应:NH3+HCl=NH4Cl
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
1L含有HNO3、Fe(NO3)3、Cu(NO3)2三种溶质的溶液,三者的物质的量浓度之比为4﹕1﹕1,慢慢向其中加入铁粉,以下图象正确的是(横坐标表示加入Fe的物质的量,单位:mol;纵坐标表示Fe2+的物质的量浓度,单位:mol·L-1) ( )
A.
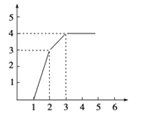 B.
B. 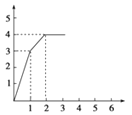 C.
C. 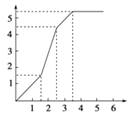 D.
D. 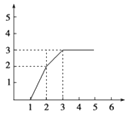
难度: 困难查看答案及解析