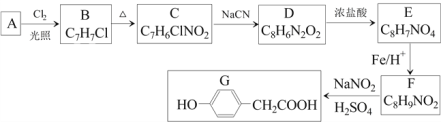
-
化学与生活密切相关,下列说法错误的是:
A. 纤维素和淀粉水解的最终产物相同
B. 二氧化硫有漂白性,可用于纸浆的漂白
C. 车用乙醇汽油的使用有利于减少人类对石油的依赖
D. 加碘食盐中含碘物质主要是KI
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列叙述正确的是:
A. 42g己烯中含有碳氢键数目为3NA个
B. 5.6g Fe与足量盐酸完全反应时,失去电子数目为0.2 NA
C. 若1 mol AlCl3完全转化为Al(OH)3胶体,则分散系中胶体微粒数为NA
D. 将0.1 mol N2与0.3 mol H2在一定条件下充分反应,生成0.2 NA个 NH3分子
难度: 中等查看答案及解析
-
我国科学家屠呦呦因创造性地研制出抗疟新药青蒿素和双氢青蒿素(对疟原虫有100%的抑制率)而获2015年诺贝尔医学奖。如图为青蒿素的键线式,以下关于青蒿素的说法错误的是
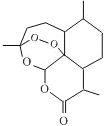
A. 含有酯基,可水解
B. 含有过氧键,有较强氧化性,且不够稳定
C. 青蒿素的化学式C15 H24O5
D. 在水中溶解度不大,易溶于有机溶剂
难度: 简单查看答案及解析
-
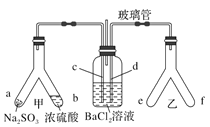
某兴趣小组探究SO2气体的还原性,装置如图所示,下列说法不合理的是
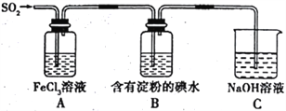
A. A装置中FeCl3溶液逐渐变为浅绿色,可以说明SO2有还原性
B. B装置中蓝色退去,说明还原性:SO2>I-
C. C装置中吸收尾气有可能倒吸
D. A、B装置中发生的反应转移电子数一定相等。
难度: 中等查看答案及解析
-
已知a、b、c、d四种短周期主族元素,在周期表中相对位置如图,下列说法正确的是
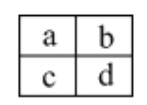
A. a、c两元素的最高正价一定相等
B. 原子半径大小顺序为:c>d>b>a
C. a、b两元素可能形成多种共价化合物
D. c、d二种元素气态氢化物的稳定性比较:c > d
难度: 中等查看答案及解析
-
用阴离子交换膜控制电解液中OH-的浓度制备纳米Cu2O,反应为2Cu+H2O
Cu2O+H2↑,装置如图,下列说法中正确的是
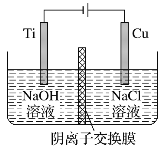
A. 电解时Cl-通过交换膜向Ti极移动
B. 阳极发生的反应为:2Cu -2e- +2OH- = Cu2O+H2O
C. 阴极OH-放电,有O2生成
D. Ti电极和Cu电极生成物物质的量之比为2∶1
难度: 中等查看答案及解析
-
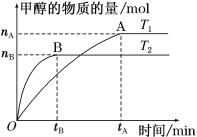
25℃时,草酸溶液中部分微粒的物质的量浓度随NaOH溶液的加入pH 的变化如图所示。其中c (H2C2O4) +c (HC2O4-)+ c (C2O42-)=0.1mol/L,下列说法不正确的是
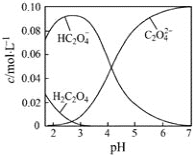
A. H2C2O4的Ka2数量级为10-5
B. NaHC2O4溶液中,c (Na+)>c(HC2O4-)>c (H+)>c (OH-)
C. 0.1mol/L 的H2C2O4溶液,H2C2O4的电离度为80%
D. pH=7.0的溶液中,c (Na+)=0.1 + c(C2O42-) - c (H2C2O4)
难度: 困难查看答案及解析