-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A. pH=l的溶液中:HCO3—、SO42—、K+、Cl-
B. 无色透明的溶液中:K+、SO42—-、Na+、MnO4—
C. 遇石蕊变蓝的溶液中:NO3—、Na+、AlO2—、K+
D. 含大量NO3—的溶液中:H+、Fe2+、Cl-、NH4+
难度: 中等查看答案及解析
-
已知微粒还原性强弱顺序:I->Fe2+>Cl-,则下列离子方程式不符合事实的是
A. 2Fe3++2I-→2Fe2++I2 B. Cl2+2I-→2Cl-+I2
C. 2Fe2++I2→2Fe3++2I- D. Fe2++Cl2→2Fe3++2Cl-
难度: 中等查看答案及解析
-
以下是中华民族为人类文明进步做出巨大贡献的几个事例,运用化学知识对其进行的分析不合理的是
A. 四千余年前用谷物酿造出酒和醋,酿造过程中只发生水解反应
B. 商代后期铸造出工艺精湛的后(司)母戊鼎,该鼎属于铜合金制品
C. 汉代烧制出“明如镜、声如磬”的瓷器,其主要原料为黏士
D. 屠呦呦用乙醚从青蒿中提取出对治疗疟疾有特效的青蒿素,该过程包括萃取操作
难度: 中等查看答案及解析
-
我国古代文明中包含着丰富的化学知识,下列过程中没有发生电子转移的是
A. 铁石制成指南针 B. 爆竹声中一岁除
C. 西汉湿法炼铜 D. 雷雨发庄稼
难度: 简单查看答案及解析
-
已知: 2KMnO4+16HCl(浓) = 2KCl+5Cl2↑+2MnCl2+8H2O,下列说法正确的是
A. HCl发生了还原反应
B. 氧化性: Cl2>KMnO4
C. 氧化剂与还原剂的物质的量比为1 : 8
D. 当标准状况下产生22.4L氯气,转移电子数为2NA
难度: 中等查看答案及解析
-
24 mL 0.05 mol/L 的Na2SO3溶液,恰好与 20mL 0.02 mol/L的K2Cr2O7溶液完全反应,则元素Cr在被还原的产物中的化合价是
A. +6 B. +3 C. +2 D. 0
难度: 中等查看答案及解析
-
洁厕灵和84消毒液混合使用会发生反应:NaClO+2HCl=NaCl+Cl2↑+H2O,生成有毒的氯气。NA代表阿伏加德罗常数的值,下列说法正确的是
A. 每生成1mol氯气,转移的电子数为2NA
B. 1molNaCl含有的电子数为28NA
C. 1L0.2mol/LNaClO溶液中含有的次氯酸根离子数为0.2NA
D. 标准状况下,将22.4LHCl溶解在0.5L水中,形成2mol/L的盐酸
难度: 中等查看答案及解析
-
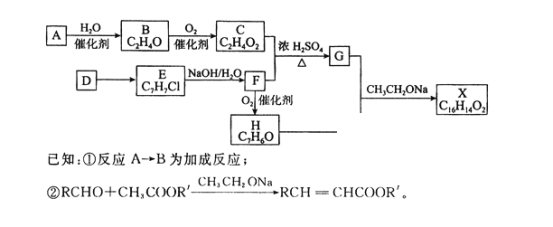
短周期主族元素X、Y、Z、W、Q的原子序数依次增大,X的气态氢化物极易溶于Y 的简单氢化物中,常温下,Z的单质能溶于W的最高价氧化物对应的水化物的稀溶液,却不溶于其浓溶液。下列说法正确的是
A. Q氧化物对应水化物的酸性强于W氧化物对应水化物的酸性
B. 原子半径大小顺序为Q>Z>W>X>Y
C. 元素X与Y组成的化合物均能溶于水
D. 元素X的简单气态氢化物比Y的简单气态氢化物稳定性差
难度: 中等查看答案及解析
-
下列实验方案能达到实验目的的是
实验目的
实验方案
A
证明Mg(OH)2 沉淀可以转化为Fe(OH)3
向2mL1mol/LNaOH溶液中先加入3滴1mol/L MgCl2溶液,再加入3滴1mol/LFeCl3
B
比较氯和碳的非金属性强弱
将盐酸滴入碳酸氢钠溶液中
C
配制100mL1.0mol/LCuSO4溶液
将25gCuSO4·5H2O溶于100mL蒸馏水中
D
验证氧化性:Fe3+>I2
将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置,观察下层液体是否变成紫色
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
化学与人类社会的生产、生活有着密切联系。下列叙述中不正确的是

氧化铁
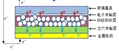
钙钛矿太阳能电池

SiO2超分子纳米管

石墨烯发热服
A.用作涂料
B.太阳能转化为电能
C.有机高分子材料
D.有电热转化性能
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 7.8g苯中含有的碳碳双键数为0.3NA
B. 15g甲基(-CH3)含有的电子数是9NA
C. 1mol C2H5OH和1mol CH3CO18OH反应生成的水分子中的中子数为8NA
D. 标准状况下,2.24 L CCl4中的原子总数为0.5NA
难度: 简单查看答案及解析
-
下列有关物质的分类或归纳的说法正确的是
A. 纯碱、氨水、蔗糖分别属于强电解质、弱电解质和非电解质
B. 乙烯、油脂、纤维素、光导纤维都属于高分子化合物
C. PM 2.5(微粒直径约为2.5×10-6 m)分散在空气中形成气溶胶,能产生丁达尔效应
D. 漂白粉、水玻璃、福尔马林都是混合物
难度: 简单查看答案及解析
-
拟除虫菊酯是一类高效、低毒、对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图,下列对该化合物叙述正确的是
A. 属于芳香烃 B. 属于卤代烃
C. 在酸性条件下不水解 D. 在一定条件下可以发生加成反应
难度: 简单查看答案及解析
-
(题文)下列实验操作能达到实验目的的是

A. 图甲装置可证明非金属性强弱:S>C>Si
B. 图乙装置可用于检验有乙烯生成
C. 图丙装置可通过蒸干AlCl3饱和溶液制备AlCl3晶体
D. 图丁装置可用来测定中和热
难度: 中等查看答案及解析
-
将标准状况下的a L HCl (g)溶于1000 g水中,得到的盐酸密度为b g·cm-3,则该盐酸的物质的量浓度是
A. a/22.4mol/L B. ab/2240 mol/L
C. ab/(22400+36.5) mol/L D. 1000ab/(22400+36.5a) mol/L
难度: 简单查看答案及解析
-
下列指定反应的离子方程式正确的是
A. 将过量SO2通入氢氧化钠溶液:2OH-+SO2=SO32-+H2O
B. 向偏铝酸钠和碳酸钠的混合溶液中滴加少量盐酸:AlO2—+H++H2O=Al(OH)3↓
C. 向碘化亚铁溶液中滴加少量稀硝酸:NO3—+3Fe2++4H+=3Fe3++NO↑+2H2O
D. 向氯化铝溶液中滴加硫化钠溶液:3S2-+2Al3+=Al2S3↓
难度: 中等查看答案及解析
-
下列装置或操作能达到实验目的的是
A. 实验室制取并收集氨气
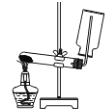 B. 构成铜锌原电池
B. 构成铜锌原电池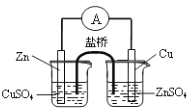 C. 检查装置气密性
C. 检查装置气密性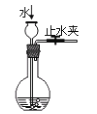 D. 利用排空气法收集二氧化碳
D. 利用排空气法收集二氧化碳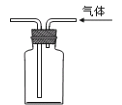
难度: 中等查看答案及解析
-
一定量的铁、铝合金与300ml 2mol/L硝酸完全反应生成3.36LNO(标况)和三价铁盐、铝盐等,再向反应后的溶液中加入1mol/L的NaOH溶液,使铝、铁元素完全沉淀下来,则所加NaOH溶液的体积是
A. 150ml B. 200ml C. 450ml D. 无法计算
难度: 中等查看答案及解析
-
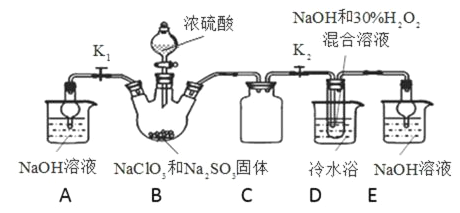
现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽。利用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液。
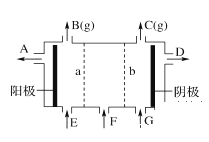
下列说法中正确的是
A. 阴极反应式为4OH--4e-=2H2O+O2↑ B. 从D口出来的是硫酸溶液
C. b是阳离子交换膜,允许Na+通过 D. Na2SO4溶液从E口加入
难度: 中等查看答案及解析
-
在(NH4)2Fe(SO4)2溶液中逐滴加入200 mL 1 mol/L的Ba(OH)2溶液,把所得沉淀过滤、洗涤、干燥,得到的固体质量不可能是
A. 70 g B. 66g C. 42g D. 20 g
难度: 中等查看答案及解析
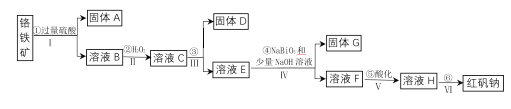
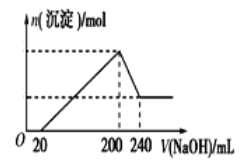 。
。