-
25℃时,某溶液中由水电离产生的C(H+)和C(OH-)的乘积为1×10-20,该溶液中一定能大量存在的离子是
A. CO32- B. HCO3- C. Ba2+ D. NH4+
难度: 中等查看答案及解析
-
实验操作规范且能达到目的是( )
目的
操作
A.
取20.00 mL盐酸
在50 mL酸式滴定管中装入盐酸,调整初始读数为30.00mL后,将剩余盐酸放入锥形瓶
B.
清洗碘升华实验所用试管
先用酒精清洗,再用水清洗
C.
测定醋酸钠溶液pH
用玻璃棒蘸取溶液,点在湿润的pH试纸上
D.
配制浓度为0.010mol/L的KMnO4溶液
称取KMnO4固体0.158 g,放入100 mL容量瓶中,加水溶解并稀释至刻度
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列物质中属于弱电解质的是
A. 冰醋酸 B. H2SO4溶液 C. BaSO4 D. Cl2
难度: 简单查看答案及解析
-
下列热化学方程式中△H代表燃烧热的是( )
A. CH4(g)+3/2O2(g)=2H2O(l)+CO(g) △H1
B. S(s)+3/2O2(g)=SO3(s) △H2
C. C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l) △H3
D. 2CO(g)+O2(g)=2CO2(g) △H4
难度: 中等查看答案及解析
-
下列关于电离常数(K)的说法正确的是
A. 电离平衡常数只与温度有关,升高温度,K值减小
B. 电离常数K与温度无关
C. 电离常数(K)越小,表示弱电解质的电力能力越弱
D. 多元弱酸各步电离常数相互关系为K1<K2<K3
难度: 简单查看答案及解析
-
常温下,最适宜薄荷生长的土壤pH≈8,土壤中的c(OH—) 最接近于
A. 1×10-5 mol/L B. 1×10-6 mol/L C. 1×10-8 mol/L D. 1×10-9 mol/L
难度: 简单查看答案及解析
-
常温下,一定浓度的某溶液,由水电离出的c(OH−)=1×10−4 mol/L,则该溶液中的溶质可能是
A. H2SO4 B. NaOH C. KHSO4 D. CH3COONa
难度: 简单查看答案及解析
-
一定条件下,在恒容密闭容器中,能表示反应X+2Y
2Z一定达到化学平衡状态的是
A. Z(气体)的浓度不再发生变化 B. X、Y、Z的物质的量之比是1∶2∶2
C. 容器气体的总压强不再发生变化 D. 单位时间内生成n mol Z,同时消耗2n mol Y
难度: 简单查看答案及解析
-
0.1mol/LCH3COOH溶液加水稀释或升高温度的过程中,下列表达式的数值一定变大的是
A. c(H+) B. c(H+)·c(OH-) C.
D.
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法中不正确的是
A. 某密闭容器中盛有0.2 mol SO2和0.1 mol O2,一定条件下充分反应,生成SO3分子数小于0.2 NA
B. 一定条件下,2.3 g Na与O2完全反应生成3.6 g产物时失去的电子数0.1 NA
C. 25℃时,pH=13的Ba(OH)2溶液中含有OH-的数目为 0.1 NA
D. 20g D2O中含有的质子数为10 NA
难度: 中等查看答案及解析
-
醋酸的电离方程式为CH3COOH(aq)
H+(aq)+CH3COO-(aq) ΔH>0。25℃时,0.1mol/L醋酸溶液中存在下述关系:Ka=c(H+).c(CH3COO-)/c(CH3COOH)=1.75×10-5,其中的数值是该温度下醋酸的电离平衡常数(Ka)。下列说法正确的是
A. 向该溶液中滴加几滴浓盐酸,平衡逆向移动,c(H+)减小
B. 向该溶液中加少量CH3COONa固体,平衡正向移动
C. 该温度下0.01mol/L醋酸溶液Ka<1.75×10-5
D. 升高温度,c(H+)增大,Ka变大
难度: 简单查看答案及解析
-
水的电离平衡曲线如下图所示。下列说法正确的是
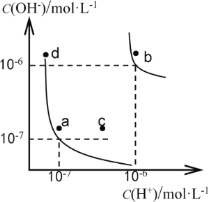
A. 图中对应点的温度关系为: a>b
B. 水的电离常数KW数值大小关系为:b>d
C. 温度不变,加入少量NaOH可使溶液从c点变到a点
D. 在b点对应温度下,将pH=2的H2SO4与pH=10的NaOH溶液等体积混合后,溶液显酸性
难度: 中等查看答案及解析
-
下图是将SO2转化为重要的化工原料H2SO4的原理示意图,下列说法不正确的是
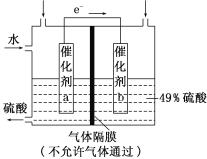
A. 该装置将化学能转化为电能
B. 催化剂b表面O2发生还原反应,其附近酸性增强
C. 催化剂a表面的反应是:SO2+2H2O-2e-===SO42-+4H+
D. 若得到的硫酸浓度仍为49%,则理论上参加反应的SO2与加入的H2O的质量比为8∶15
难度: 困难查看答案及解析
-
某密闭容器中发生如下反应:X(g)+3Y(g)
2Z(g);ΔH<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是( )
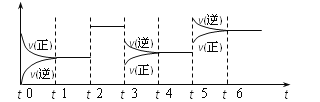
A. t5时增大了压强 B. t3时降低了温度
C. t2时加入了催化剂 D. t4~t5时间内转化率一定最低
难度: 中等查看答案及解析
-
某同学在实验报告中记录了以下数据:
①用量筒量取7.34mL盐酸;②用托盘天平称取8.7g食盐;③用标准盐酸溶液滴定未知浓度的NaOH溶液,用去盐酸23.10mL;④用广范pH试纸测得某溶液的pH是4.5,其中数据合理的是
A. ①④ B. ②③ C. ①③ D. ①②
难度: 简单查看答案及解析
-
已知反应:2NO2(红棕色)
N2O4(无色),分别进行如下两个实验:
实验ⅰ:将NO2球分别浸泡在热水和冰水中,现象如图1。
实验ⅱ:将一定量的NO2充入注射器中后封口,测定改变注射器体积的过程中气体透光率随时间的变化(气体颜色越深,透光率越小),如图2。下列说法不正确的是
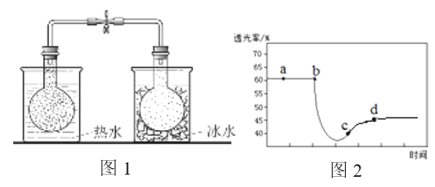
A. 图1现象说明该反应为放热反应
B. 图2中b点的操作是压缩注射器
C. c点:v(正)>v(逆)
D. 若不忽略体系温度变化,且没有能量损失,则T(d)<T(c)
难度: 中等查看答案及解析