-
下列各图所反映的措施中,目的是为了加快其化学反应速率的是
A.
 B.
B. 
C.
 D.
D. 
难度: 中等查看答案及解析
-
下列叙述中正确的是
A. 在稀溶液中,1 mol酸和1 mol碱完全反应所放出的热量,叫做中和热
B. 在101 kPa时,1 mol物质燃烧时所放出的热量叫做该物质的燃烧热
C. 热化学方程式中,各物质前的化学计量数不表示分子个数
D. 如果反应物所具有的总能量小于生成物所具有的总能量,则发生的反应是放热反应
难度: 中等查看答案及解析
-
下列反应既属于氧化还原反应,又属于放热反应的是
A. 铝片与稀盐酸的反应
B. Ba(OH)2·8H2O与NH4Cl晶体的反应
C. 灼热的炭与二氧化碳的反应
D. 碳酸氢钠受热分解
难度: 简单查看答案及解析
-
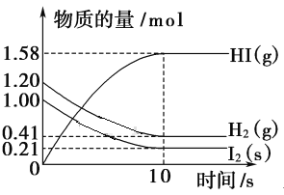
某实验小组学生用50 mL 0.50 mol·L−1盐酸与50 mL 0.55 mol·L−1 NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中放出的热量计算中和热。下列说法正确的是
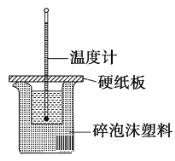
A. 实验过程中没有热量损失
B. 图中实验装置缺少环形玻璃搅拌棒
C. 烧杯间填满碎泡沫塑料的作用是固定小烧杯
D. 酸或碱的物质的量越大,所测中和热的数值越大
难度: 简单查看答案及解析
-
进行如下实验,在A锥形瓶中放入10g块状CaCO3,在B锥形瓶中放入5g粉末状CaCO3,分别加入50mL2mol/L盐酸。下图中能正确表示实验结果的是

难度: 中等查看答案及解析
-
已知450℃时,2SO2(g)+O2(g)
2SO3(g) ΔH=-Q1。在相同条件下,向一密闭容器中通入1 mol SO2和0.5 mol O2,达到平衡时放出的热量为Q2,则Q1、Q2满足的关系是( )
A.Q2=Q1/2 B.Q2<Q1/2 C.Q2>Q1/2 D.不能确定
难度: 中等查看答案及解析
-
有两位同学在条件相同的情况下,测定可逆反应:A2(g)+3B2(g)
C2(g)的化学反应速率。甲测得:v(A)=0.5 mol·L−1·min−1,乙测得:v(B)= 1.5 mol·L−1·min−1,则这两位同学的测定结果
A. 都正确 B. 都不正确
C. 甲正确,乙不正确 D. 甲不正确,乙正确
难度: 简单查看答案及解析
-
用CH4催化还原NOx可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)
4NO(g)+CO2(g)+2H2O(g) ΔH=−574 kJ·mol−1
②CH4(g)+4NO(g)
2N2(g)+CO2(g)+2H2O(g) ΔH=−1 160 kJ·mol−1
下列说法不正确的是
A. 由反应①可推知:CH4(g)+4NO2(g)
4NO(g)+CO2(g)+2H2O(l) ΔH=−Q,Q>574 kJ·mol−1
B. 等物质的量的甲烷分别参加反应①、②,反应转移的电子数不同
C. 若用标准状况下4.48 L CH4还原NO2至N2,则放出的热量为173.4 kJ
D. 若用标准状况下4.48 L CH4还原NO2至N2,则整个过程中转移的电子总物质的量为1.6 mol
难度: 困难查看答案及解析
-
已知:Na2S2O3+H2SO4===Na2SO4+SO2↑+S↓+H2O,下列各组实验中,反应速率最快的是
组号
反应
温度/℃Na2S2O3
H2SO4
H2O
体积/ mL
浓度/ mol·L-1
体积/ mL
浓度/ mol·L-1
体积/ mL
A
10
5
0.2
5
0.1
10
B
10
5
0.1
5
0.1
10
C
30
5
0.1
5
0.1
10
D
30
5
0.2
5
0.2
10
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
对于反应CH2=CH2+H2 → CH3CH3,反应过程的能量变化如图所示。下列说法正确的是
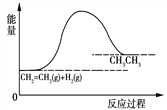
A. 此反应不属于氧化还原反应
B. 此反应的ΔH<0
C. 此反应中反应物的能量总和大于产物的能量总和
D. 1分子乙烯和1分子氢气的键能总和大于1分子乙烷的键能总和
难度: 简单查看答案及解析
-
如图表示可逆反应mA(g)+nB(s)
xC(g)在不同温度和压强下,反应物A的转化率变化情况。下列判断正确的是
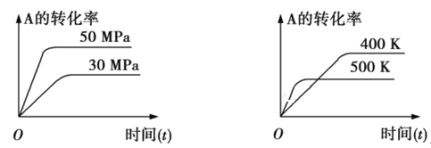
A. m>x,正反应为放热反应 B. m+n<x,正反应为吸热反应
C. m<x,正反应为放热反应 D. m>x,正反应为吸热反应
难度: 中等查看答案及解析
-
对已经达到化学平衡的2X(g)+Y(g)
2Z(g)减小压强时,对反应的影响是( )
A. 逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B. 逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C. 正、逆反应速率都减小,平衡向逆反应方向移动
D. 正、逆反应速率都增大,平衡向正反应方向移动
难度: 中等查看答案及解析
-
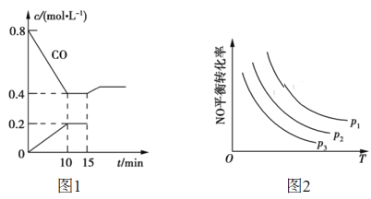
汽车尾气净化中的一个反应如下:NO(g)+CO(g)
1/2N2(g)+CO2(g) ΔH=-373.4 kJ·mol-1,在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是
A.
 B.
B.  C.
C.  D.
D. 
难度: 困难查看答案及解析
-
在恒温、体积为2 L的密闭容器中加入1 mol CO2和3 mol H2,发生如下的反应:CO2(g)+3H2(g)
CH3OH(g)+H2O(g) ΔH<0。可认定该可逆反应在一定条件下已达到化学平衡状态的是
A. 容器中CO2、H2、CH3OH、H2O的物质的量之比为1∶3∶1∶1
B. v正(CO2)=v逆(H2O)
C. 容器内混合气体密度保持不变
D. 3 mol H−H键断裂同时断裂3 mol H−O键
难度: 中等查看答案及解析
-
反应:L(s)+aG(g)
bR(g)达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡时混合气体中G的体积分数。据此可判断( )
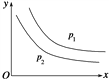
①上述反应是放热反应 ②上述反应是吸热反应 ③a>b ④a<b
A. ①③ B. ①④ C. ②③ D. ②④
难度: 困难查看答案及解析
-
在密闭容器中发生反应m A(g)+n B(g)
p C(g),达到平衡后,保持温度不变,将气体体积缩小到原来的1/2,当达到新平衡时,C的浓度为原来的1.9倍,下列说法正确的是
A. m+n>p B. 平衡向逆反应方向移动 C. A的转化率提高 D. C的体积分数增加
难度: 中等查看答案及解析
-
在某一恒温、恒容的密闭容器中发生反应:3H2(g)+N2(g)
2NH3(g) ΔH<0。t1时刻反应达到平衡,在t2时刻改变某一条件,其反应过程如图所示。下列说法正确的是
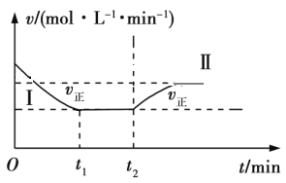
A. Ⅰ、Ⅱ两过程达到平衡时,平衡常数:KⅠ<KⅡ
B. Ⅰ、Ⅱ两过程达到平衡时,NH3的体积分数:Ⅰ<Ⅱ
C. Ⅰ、Ⅱ两过程达到平衡的标志:气体的平均密度不再发生变化
D. t2时刻改变的条件可以是向密闭容器中加H2和N2的混合气
难度: 困难查看答案及解析
-
一定条件下,在体积为3L的密闭容器中,发生反应:CO(g)+2H2(g)
CH3OH(g),在不同温度下甲醇的物质的量随时间的变化如图所示。下列叙述正确的是
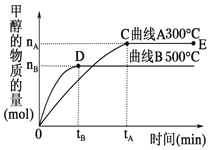
A. 平衡常数K(300 ℃)<K(500 ℃)
B. 在其他条件不变时,压缩处于E点的体系体积,氢气浓度增大
C. 300 ℃,当容器内气体密度不变时说明反应已经达到平衡
D. 500 ℃,从反应开始到平衡,氢气的平均反应速率v(H2)=
mol·L−1·min−1
难度: 中等查看答案及解析