-
下列事实或操作不符合平衡移动原理的是( )
A. 开启啤酒有泡沫逸出
B. 向FeCl3溶液中加KSCN,有FeCl3+3KSCN⇌3KCl+Fe(SCN)3(血红色)反应,平衡后向体系中加入KCl固体使体系红色变浅。
C. 装有NO2的烧瓶置于热水中颜色加深
D. 实验室用排饱和食盐水的方法收集氯气
难度: 中等查看答案及解析
-
在一密闭容器中,反应aA(g)bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的60%,则( )
A. a<b B. 平衡向逆反应方向移动了
C. 平衡向正反应方向移动了 D. 物质B的质量分数增加了
难度: 中等查看答案及解析
-
已建立化学平衡的某可逆反应,当条件改变使化学平衡向正反应方向移动时,下列叙述正确的是
①生成物的质量分数一定增加 ②生成物的物质的量一定增加 ③反应物的转化率一定增大 ④平衡时反应物的浓度一定降低 ⑤正反应速率一定大于逆反应速率 ⑥一定使用了催化剂
A. ①②⑤ B. ④⑥ C. ②⑤ D. ③④⑤
难度: 中等查看答案及解析
-
化学与能源开发、环境保护、资源利用等密切相关
下列说法正确的是
A. 天然气、石油、流水、风力、氢气为一级能源
B. 无论是风力发电还是火力发电,都是将化学能转化为电能
C. PM
含有的铅、镉、铬、钒、砷等对人体有害的元素均是金属元素
D. 发展低碳经济、循环经济,推广利用太阳能、风能的城市照明系统
难度: 简单查看答案及解析
-
下列各组物质的燃烧热相等的是
A. C2H4和C3H6 B. 1mol碳和3mol碳 C. 白磷和红磷 D. 淀粉和纤维素
难度: 中等查看答案及解析
-
已知723 K时,2SO2(g)+O2(g)
2SO3(g)ΔH=﹣QkJ·mol-1,在相同条件下,向一密闭容器中通入2 mol SO2和1 mol O2,达到平衡时放出的热量为Q1kJ;向另一体积相同的密闭容器中通入1 mol SO2和0.5 mol O2,达到平衡时放出的热量为Q2kJ.则Q1、Q2、Q满足的关系是
A. Q2=Q1/2 B. Q2>Q1/2 C. Q2<Q1<Q D. Q=Q1>Q2
难度: 中等查看答案及解析
-
H2和I2在一定条件下发生反应:H2(g)+I2(g)
2HI(g) ΔH=-akJ·mol-1。已知:
 (a、b、c均大于零)
(a、b、c均大于零)下列说法不正确的是
A. 该反应中反应物的总能量高于生成物的总能量
B. 断开1 mol H—H键和1 mol I—I键所需能量大于断开2 mol H—I键所需能量
C. 断开2 mol H—I键所需能量约为(a+b+c) kJ
D. 向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于2akJ
难度: 困难查看答案及解析
-
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法中正确的是

A. 1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ
B. NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
C. 在1 L的容器中发生反应,10 min内 N2减少了1 mol,因此10 min内的平均反应速率为v(NO)=0.1 mol·
•
D. 1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量
难度: 中等查看答案及解析
-
一定条件下,在水溶液中1 mol Cl﹣,ClOx-(x=1,2,3,4)的能量(kJ)相对大小如图所示。下列有关说法正确的是

A. e是ClO3-
B. b→a+c反应的活化能为60 kJ•mol﹣1
C. a,b,c,d,e中c最稳定
D. b→a+d反应的热化学方程式为3ClO﹣(aq)=== ClO3-(aq)+2Cl﹣(aq)ΔH=﹣116 kJ•mol﹣1
难度: 中等查看答案及解析
-
在密闭容器中进行可逆反应,A跟B反应生成C,反应速率v(A)、v(B)、v(C)之间存在以下关系:v(B)=3v(A),v(C)=2v(A),3v(C)=2v(B),则该反应可以表示为( )
A. A+B
C B. 2A+2B
3C
C. 3A+B
2C D. A+3B
2C
难度: 简单查看答案及解析
-
在一密闭容器中充入一定量的N2和O2,在电火花作用下发生反应N2+O2===2NO,经测定前3 s用N2表示的反应速率为0.1 mol/(L·s),则6 s末NO的浓度为
A. 1.2 mol/L B. 大于1.2 mol/L C. 小于1.2 mol/L D. 不能确定
难度: 简单查看答案及解析
-
已知298K时,合成氨反应:N2 (g ) + 3H2 ( g )
2NH3 ( g ) △H =-92.0 kJ/mol,将此温度下的1 mol N2 和3 mol H2 放在一密闭容器中,在催化剂存在时进行反应,达到平衡时,反应放出的热量为(忽略能量损失)
A. 一定大于92.0 kJ B. 一定小于92.0 kJ
C. 一定等于92.0 kJ D. 不能确定
难度: 简单查看答案及解析
-
已知 3A(g)+2B(g)
C(s)+4D(g) △H <0。 图中a、b表示在一定条件下,A的体积分数随时间t的变化。若使曲线b变为曲线a,可采取的措施是

A. 增大A的浓度 B. 升高温度 C. 加催化剂 D. 缩小容器体积
难度: 中等查看答案及解析
-
在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g)
2SO3(g)△H<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )

A. 图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响
B. 图Ⅱ表示的是t1时刻加入催化剂后对反应速率的影响
C. 图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙高
D. 图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高
难度: 中等查看答案及解析
-
对可逆反应4NH3(g)+ 5O2(g)
4NO(g)+ 6H2O(g),下列叙述正确的是
A. 达到化学平衡时,4υ正(O2)= 5υ逆(NO)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态
C. 达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大
D. 化学反应速率关系是:2υ正(NH3)= 3υ正(H2O)
难度: 中等查看答案及解析
-
对于可逆反应N2(g)+3H2(g)
2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是

A. ①压强对反应的影响(p2>p1) B. ②温度对反应的影响
C. ③平衡体系增加N2对反应的影响 D. ④催化剂对反应的影响
难度: 中等查看答案及解析
-
有一处于平衡状态的反应X(g) +3Y(g)
2Z(g) (正反应是放热反应) 。为了使平衡向生成Z的方向移动, 应选择的条件是
①升高温度 ②降低温度 ③增大压强 ④降低压强 ⑤加入正催化剂 ⑥分离出Z
A. ①③⑤ B. ②③⑤ C. ②③⑥ D. ②④⑥
难度: 简单查看答案及解析
-
化合物在水溶液中因存在以下电离平衡:HIn(红色)
H++In-(黄色),故可用作酸碱指示剂。浓度为0.4mol/L的下列各溶液:①盐酸 ②石灰水 ③NaCl溶液 ④NaHSO4溶液 ⑤硝酸钾溶液 ⑥氨水,其中能使指示剂显红色的是( )
A.①④ B.②⑤⑥ C.①④⑤ D.②③⑥
难度: 中等查看答案及解析
-
在一个容积为2 L的密闭容器中,加入0.8 mol的A2气体和0.6 mol B2气体,一定条件下发生如下反应:A2(g)+B2(g)
2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是
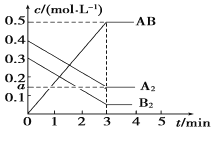
A. 图中a点的值为0.15 B. 该反应的平衡常数K=0.03
C. 温度升高,平衡常数K值减小 D. 平衡时A2的转化率为62.5%
难度: 中等查看答案及解析
-
500 ℃条件下,在恒容密闭容器中,充入1 mol NO2存在如下平衡:2NO2(g)
N2O4(g)。平衡后,向容器内再充入1 mol NO2,下列说法正确的是
A. 平衡向正反应方向移动 B. 平衡常数K增大
C. NO2的转化率变小 D. 容器内气体颜色先变深后变浅,最后比原来还要浅
难度: 中等查看答案及解析
-
某温度时,反应SO2(g)+1/2O2(g)
SO3(g)的平衡常数K=50。在同一温度下,反应2SO3(g)
2SO2 (g)+O2(g)的平衡常数K1应为( )
A. 2 500 B. 100 C. 4×10-4 D. 2×10-2
难度: 中等查看答案及解析
-
完全燃烧一定质量的无水乙醇,放出的热量为Q,已知为了完全吸收生成的二氧化碳,消耗50mL 8mol/L的氢氧化钠溶液,则无水乙醇的燃烧放出的热量不可能是( )
A. 10Q B. 5Q~10Q C. 大于10Q或小于5Q D. 小于8Q
难度: 困难查看答案及解析
-
将a L NH3通入某恒压的密闭容器中,在一定条件下让其分解,达到平衡后气体体积增大到b L(气体体积在相同条件下测定)。下列说法中正确的是
A. 平衡后氨气的分解率为
×100% B. 平衡混合气体中H2的体积分数为
×100%
C. 反应前后气体的密度比为a/b D. 平衡后气体的平均摩尔质量为17a/b g
难度: 中等查看答案及解析