-
化学为人类提供了更多的生活、生产资料。下列做法利用了化学变化的是
A. 铁铸成锅 B. 干冰制冷 C. 盐酸除锈 D. 海水晒盐
难度: 简单查看答案及解析
-
下列基本实验操作正确的是
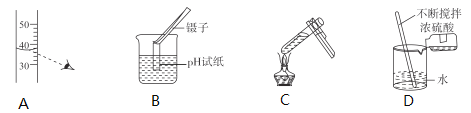
A. 读出液体体积 B. 测溶液的pH
C. 加热液体 D. 稀释浓硫酸
难度: 中等查看答案及解析
-
根据所学知识判断,下列做法正确的是
A. 用氢氧化钠改良酸性土壤
B. 用煮沸的方法降低水的硬度
C. 用湿抹布擦洗防止菜刀生锈
D. 液化气泄漏,立即开灯检查
难度: 简单查看答案及解析
-
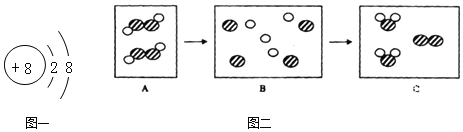
下列关于宏观事实的微观解释,正确的是
A. 冰水混合物属于纯净物——冰和水都含有相同的原子
B. 干冰升华——二氧化碳分子的体积变大
C. H2O和H2O2的化学性质不同——分子构成不同
D. Fe、Fe2+、Fe3+化学性质不同——微粒中的质子数不同
难度: 简单查看答案及解析
-
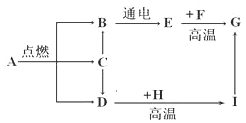
科学研究表明,氨气在常压下就可液化为液氨,液氨可用作汽车的清洁燃料,其燃烧时的主要反应为:4NH3+3O2
2X+6H2O。下列说法中不正确的是
A. 液氨属于混合物 B. 组成X的元素化合价为零
C. 该反应属于置换反应 D. X充入食品包装中可以防腐
难度: 简单查看答案及解析
-
下列有关说法中,正确的是
①将空气依次通过足量的NaOH溶液、浓硫酸、灼热的铜网,可得到含少量稀有气体的氮气;
②露置在空气中的浓硫酸和浓盐酸,一段时间后溶质质量分数减小的原理相同;
③降低可燃物的着火点是灭火的途径之一;
④Al可以实现单质
氧化物
碱的转化;
⑤实现CuO→Cu的转化,可以利用C、CO、H2的还原性
A. ①⑤ B. ①②③ C. ②③④ D. ①③⑤
难度: 困难查看答案及解析
-
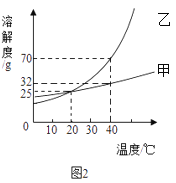
烧杯内原有某物质,向其中加入物质X,X的质量与变量Y的关系如图,下列一定能正确反应X、Y对应关系的是
选项
烧杯内原有的物质
X
Y
A
氯化钠溶液
氯化钠固体
溶液中溶质的质量分数
B
水
硝酸铵固体
溶液的温度
C
硫酸铜溶液
铁粉
溶液中溶质的质量
D
稀硫酸
氧化铜
溶液中氧元素的质量
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
在研究Zn—Cu合金、Zn—Fe合金、Fe—Al合金、Fe—Cu合金时,发现其中一种合金6.5g与足量稀硫酸充分反应产生了0.5g气体,该合金可能是
A. Zn—Cu合金 B. Fe—Al合金 C. Zn—Fe合金 D. Fe—Cu合金
难度: 困难查看答案及解析