-
分类法是学习和研究物质的一种重要方法,下列分类正确的是
A. 生铁、黄金、金刚石——合金 B. 纯碱、烧碱、熟石灰——碱
C. 氮气、红磷、铝—— 单质 D. 水、干冰、氯酸钾——氧化物
-
下列有关叙述正确的是
A. 分离Zn和Fe的固体混合物,加适量的FeSO4溶液后过滤
B. 除去CO2气体中混有的HCl气体,依次通过足量的NaOH溶液和浓硫酸
C. 配制50g质量分数为6%的NaOH溶液,将NaOH固体放到纸上称量,再用50mL量筒量取水
D. 鉴别NaOH溶液、Ca(OH)2溶液和稀硫酸,可用一种试剂一次鉴别
-
根据你的化学知识和生活经验判断,下列说法错误的是( )
A. 取2mL鸡蛋清,加入几滴硫酸铜溶液,鸡蛋清凝结
B. CO2和SO2都能与碱溶液反应,所以非金属氧化物都能与碱溶液反应
C. 吃松花蛋时可加入少量食醋,因为食醋能消除蛋中所含碱性物质的涩味
D. 用浓溶液配制稀溶液时用量筒量取浓溶液,仰视读取数据,会使配得的质量分数偏大
-
下列“家庭小实验”中,不能达到预期目的是( )
A. 用苏打水除水垢
B. 用酒精浸泡植物的花瓣制酸碱指示剂
C. 用柠檬酸、果汁、白糖、水、小苏打等制汽水
D. 用氢氧化钠溶液制作叶脉书签
-
下列说法正确的是( )
A. 将浓硫酸缓慢注入水中,水立刻沸腾,液滴飞溅
B. 生铁和钢组成元素相同,性质相同
C. 铁粉可做食品保鲜剂﹣﹣铁粉可以和空气中的氧气和水反应
D. 金刚石能裁玻璃﹣﹣金刚石是硬度最大的金属
-
用所给实验器材(规格和数量不限),就能顺利完成相应实验的是( )
| 选项 | 相应实验 | 实验器材(省略夹持装置) |
| A | 硫酸铜晶体的制备和生长 | 烧杯、玻璃棒、蒸发皿、量筒 |
| B | 分离氯化钾和二氧化锰的混合物 | 烧杯、玻璃棒、胶头滴管、滤纸 |
| C | 用固体氯化钠配制5%的溶液 | 烧杯、玻璃棒、胶头滴管、量筒 |
| D | 用pH试纸测定溶液的酸碱性强弱 | 烧杯、玻璃棒、pH试纸、标准比色卡 |
A. A B. B C. C D. D
-
根据下图所示的四个实验,得出的结论正确的是( )
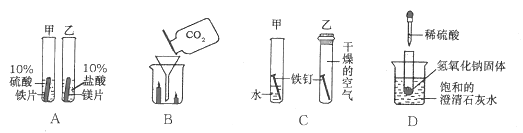
A. 乙试管中产生气泡速率大于甲试管中产生气泡速率,说明金属活动性:镁>铁
B. 蜡烛由低到高依次熄灭,说明通常状况下CO2不能燃烧,不支持燃烧,密度大于空气
C. 甲试管中的铁钉生锈,乙试管中的铁钉不生锈,说明只需与水接触铁钉就会生锈
D. 向盛有NaOH固体的试管中滴加稀硫酸,烧杯中饱和的澄清石灰水变浑浊,说明H2SO4与NaOH发生中和反应放出热量
-
甲、乙、丙有如图所示的转化关系(“→”表示反应一步实现,部分物质和反应条件已略去),下列各组物质按照甲、乙、丙的顺序不符合要求的是( )
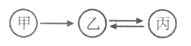
A. C、CO、CO2 B. H2O2、H2O、O2
C. KOH、K2CO3、KNO3 D. Fe2O3、FeCl3、Fe(OH)3
-
归纳推理是化学学习中常用的方法。下列推理正确的是( )
A. 有氧气参加的反应一定是氧化反应,则氧化反应一定有氧气参加
B. 酸能与碱反应生成盐和水,能与碱反应生成盐和水的物质一定是酸
C. 置换反应中一定有元素化合价发生变化,则有元素化合价发生变化的反应一定是置换反应
D. 稀盐酸能用来除去铁制品表面的铁锈,因为稀盐酸能与某些金属氧化物反应
-
下列操作,现象和结论都正确的是( )
| 序号 | 操作 | 现象 | 结论 |
| A | 向某固体滴加稀盐酸 | 有气泡产生 | 该固体是碳酸盐 |
| B | 在空气中加热除去碳粉中的杂质铜粉 | 粉末完全变黑 | 碳粉中杂质已除尽 |
| C | 向某固体滴加氢氧化钾溶液,微热,将湿润的红色石蕊试纸接近试管口 | 试纸变蓝 | 该固体含铵根离子 |
| D | 向无色溶液中滴加氯化钡溶液 | 有白色沉淀产生 | 该溶液中含有硫酸根离子或银离子 |
A. A B. B C. C D. D
-
A、B、C三只小烧杯内分别依次盛有一定体积的浓氨水、酚酞溶液、酚酞溶液,按下图所示进行探究活动,不能得到的结论是( )
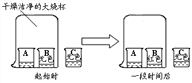
A. 氨水能使酚酞溶液变红 B. 碱能使酚酞溶液变红
C. 空气不能使酚酞溶液变红 D. 浓氨水易挥发,氨气易溶于水
-
下列设计方案可行,且化学方程式书写正确的是( )
A. 实验室用锌片与浓硫酸反应制取H2:Zn+H2SO4═ZnSO4+H2↑
B. 用Al(OH)3治疗胃酸过多症:Al(OH)3+3HCl═AlCl3+3H2O
C. 用铁粉从含硝酸银的废水中提取金属银:Fe+3AgNO3═Fe(NO3)3+3Ag
D. 用点燃的方法除去二氧化碳气体中混有的少量一氧化碳:2CO+O2═2CO2
-
向盛有20g10%氢氧化钠溶液的烧杯中逐滴滴入7.3%的稀盐酸,下列是关于溶液总质量或溶液pH随盐酸质量变化的关系图(Q点表示恰好完全反应)。其中正确的是
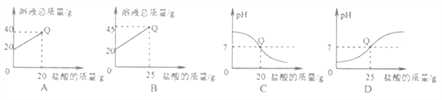
A. A B. B C. C D. D
-
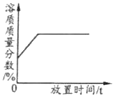
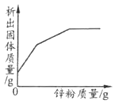
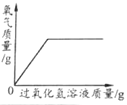
下表中,有关量的变化图像与其对应叙述相符的是
| A | B | C | D |
| 
| 
| 
| 
|
| 浓硫酸敞口放置一段时间 | 向一定质量的氧化铁粉末中加入稀盐酸 | 向一定质量AgNO3和Cu(NO3)2的混合溶液中加入Zn粉 | 向一定质量的二氧化锰中加入过氧化氢溶液 |
A. A B. B C. C D. D
-
实验室中同学们进行了如图所示实验,成功探究出了久置氢氧化钠固体的变质情况。下列说法正确的是( )

A. 甲溶液可以选择稀盐酸或CaC12溶液(查阅资料得知:CaC12溶液显中性)
B. 若Ⅱ、Ⅲ均有明显现象,则说明样品部分变质
C. D物质可能是气体,也可能是沉淀
D. 溶液B中的溶质一定只含有NaOH和甲
-
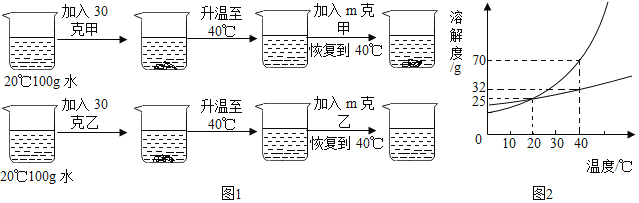
t1℃时,将等质量的硝酸钾和氯化钾分别加入到各盛有100g水的两个烧杯中,充分搅拌后现象如图1所示,硝酸钾和氯化钾的溶解度曲线如图2所示。则下列说法正确的是( )
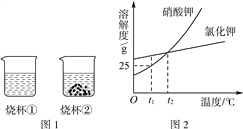
A. 烧杯①的溶液一定是不饱和溶液
B. 烧杯①的溶液是硝酸钾溶液
C. 若烧杯②的溶液升温到t2 ℃,烧杯底部还有部分物质不溶解
D. 若烧杯①和烧杯②的溶液都升温到t2 ℃,溶质的质量分数相等
-
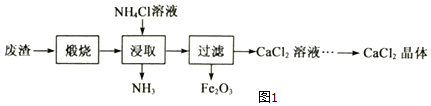
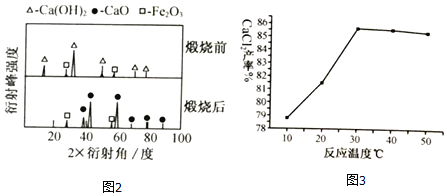
黄铁矿的主要成分为二硫化亚铁(FeS2),工业上可利用黄铁矿煅烧的产物冶炼铁和生产浓硫酸,其工业流程如图:
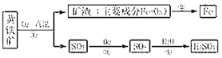
下列说法错误的是( )
A. 反应②不是置换反应,反应③④为化合反应
B. 反应①中各元素的化合价均发生了改变
C. 该工业生产过程产生的废气中的SO2可以用熟石灰溶液吸收
D. 向制得的100克98%的浓硫酸中加入100克蒸馏水,配制49%的稀硫酸
-
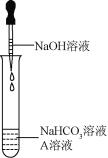
实验室有一包白色固体由K2CO3、K2SO4、KCl、CaCl2和CuSO4中的一种或几种组成,实验记录如下:①取该样品溶于水,得到无色溶液;②取适量上述溶液加过量的BaCl2溶液,出现白色沉淀,过滤;③向步骤②所得沉淀中加入过量的HNO3,沉淀全部消失并产生气泡。下列分析中正确的是( )
A. 原固体中一定含有K2CO3,可能含有 CuSO4和KCl
B. 原固体中一定不含K2SO4、CaCl2和CuSO4,可能含有KCl
C. 原固体中一定含有K2CO3,一定不含KCl、CuSO4
D. 若在步骤②所得滤液中滴入AgNO3溶液,出现白色沉淀,则原固体中一定含有KCl
-
氧烛是一种便携式供氧设备(如下图)。产氧药块由氯酸钠(分解时吸收热量为QkJ·g-1)、金属粉末(燃烧时提供氯酸钠分解所需的热量)和少量催化剂组成。某兴趣小组拟自制氧烛,火帽为确定每100g氯酸钠需要添加金属粉末的质量[m(金属)],查得下表数据:
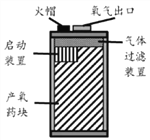

下列说法正确的是
A. m(金属)只能采用不同比例的金属和氯酸钠在空气中实验获得
B. m(金属)只能通过氯酸钠分解吸收热量与金属燃烧放出热量进行理论药块计算确定
C. m(金属)过小将使氧烛中反应无法持续进行,过大将减小产氧量
D. 不用催化剂时,分别使用铁、铝、镁作燃料,m(Fe)最小
-
某露置于空气中的CaO固体,测得其中Ca元素质量分数为50%,取10g该CaO固体样品,向其中加入足量稀盐酸使其完全溶解。正确的说法是( )
A. 加入稀盐酸后一定没有气泡产生
B. 该CaO样品的成分可能是CaO和Ca(OH)2
C. 生成CaCl2的质量为11.1g
D. 该CaO样品的成分可能是Ca(OH)2和CaCO3













 ________________
________________