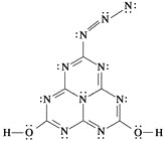
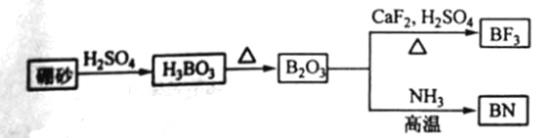
-
下面的排序不正确的是( )
A. 晶体熔点由低到高:F2<Cl2<Br2<I2
B. 熔点由高到低: Na>Mg>Al
C. 硬度由大到小: 金刚石>碳化硅>晶体硅
D. 晶格能由大到小: MgO>CaO>NaF> NaCl
难度: 中等查看答案及解析
-
下列氯元素含氧酸酸性最强的是
A、HClO B、HClO2 C、HClO3 D、HClO4
难度: 中等查看答案及解析
-
下列物质的酸性强弱比较正确的是( )
A. HBrO4<HIO4 B. H2SO4<H3PO4 C. HClO3<HClO D. H2SO4>H2SO3
难度: 简单查看答案及解析
-
金属的下列性质中和金属晶体结构无关的是( )
A. 良好的导电性 B. 反应中易失去电子
C. 良好的延展性 D. 良好的导热性
难度: 简单查看答案及解析
-
水的沸点为100℃,硫化氢的分子结构跟水相似,但它的沸点却很低,是-60.7℃,引起这种差异的主要原因是( )
A. 范德华力 B. 共价键 C. 氢键 D. 相对分子质量
难度: 中等查看答案及解析
-
下列有关化学键的叙述中,不正确的是( )
A. 某原子跟其他原子形成共价键时,其共价键数一定等于该元素原子的价电子数
B. 水分子内氧原子结合的电子数已经达到饱和,故不能再结合其他氢原子
C. 完全由非金属元素形成的化合物中也可能含有离子键
D. 配位键也具有方向性、饱和性
难度: 中等查看答案及解析
-
已知SO3,BF3,CCl4,PCl5、SF6都是非极性分子,而H2S,NH3,NO2、SF4,BrF5都是极性分子,由此可推出ABn型分子属于非极性分子的经验规律是( )
A. ABn型分子中A,B均不含氢原子
B. A元素的相对原子质量必小于B元素的相对原子质量
C. 分子中所有原子都在同一平面上
D. ABn型的价电子对数等于n
难度: 中等查看答案及解析
-
下列有关离子晶体的数据大小比较不正确的是( )
A. 熔点:NaF>MgF2>AlF3
B. 晶格能:NaF>NaCl>NaBr
C. 阴离子的配位数:CsCl>NaCl>CaF2
D. 硬度:MgO>CaO>BaO
难度: 中等查看答案及解析
-
固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的最外电子层结构,则下列有关说法,不正确的是
A. NH5中既有离子键又有共价键 B. NH5的熔沸点高于NH3
C. 1mol NH5中含有5molN—H键 D. NH5固体投入少量水中,可产生两种气体
难度: 中等查看答案及解析
-
下列有关σ键和π键的说法错误的是( )
A. 含有π键的分子在反应时,π键是化学反应的积极参与者
B. 当原子形成分子时,首先形成σ键,可能形成π键
C. 有些原子在与其他原子形成分子时只能形成σ键,不能形成π键
D. 在分子中,化学键可能只有π键而没有σ键
难度: 中等查看答案及解析
-
下列结构图中,●代表前二周期元素的原子实(原子实是原子除去最外层电子后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表价键。示例:
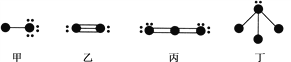
根据各图表示的结构特点,下列有关叙述正确的是( )
A. 上述结构图中共出现6种元素
B. 甲、乙、丙为非极性分子,丁为极性分子
C. 甲与丁可以发生化合反应生成离子化合物
D. 向CaCl2溶液中加入(或通入)丙有白色沉淀产生
难度: 中等查看答案及解析
-
下图中每条折线表示周期表ⅣA~ⅦA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是( )
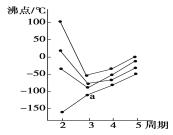
A.H2S B.HCl C.PH3 D.SiH4
难度: 中等查看答案及解析
-
下列说法中正确的是
A. NO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8电子稳定结构
B. P4和CH4都是正四面体型分子且键角都为109.5°
C. NH4+的电子式为
,离子呈平面正方形结构
D. NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强
难度: 中等查看答案及解析
-
下列叙述中,正确的是
A. 在一个基态多电子的原子中,可以有两个运动状态完全相同的电子
B. 在一个基态多电子的原子中,不可能有两个能量完全相同的电子
C. 如果某一基态原子3p轨道上仅有2个电子,它们自旋方向必然相反
D. 在一个基态多电子的原子中,M层上的电子能量肯定比L层上的电子能量高
难度: 中等查看答案及解析
-
下列关于价电子构型3s23p4的描述正确的是( )
A. 它的元素符号为O
B. 它的核外电子排布式为1s22s22p63s23p4
C. 可以与H2化合生成液态化合物
D. 其电子排布图为

难度: 中等查看答案及解析
-
把下列液体分别装在酸式滴定管中,并使其以细流流下,当用带有静电的玻璃棒接近液体细流时,细流可能发生偏移的是( )
A.CCl4 B.C2H5OH C.CS2 D.C6H6
难度: 中等查看答案及解析
-
下列事实不能用键能的大小来解释的是 ( )
A.N元素的电负性较大,但N2的化学性质很稳定
B.稀有气体一般难发生化学反应
C.HF、HCl、HBr、HI的稳定性逐渐减弱
D.F2比O2更容易与H2反应
难度: 中等查看答案及解析
-
当镁原子由1s22s22p63s2 →1s22s22p63p2时,以下认识正确的是
A. 镁原子由基态转化成激发态,这一过程中吸收能量
B. 镁原子由激发态转化成基态,这一过程中释放能量
C. 转化后位于p能级上的两个电子处于同一轨道,且自旋方向相同
D. 转化后镁原子与硅原子电子层结构相同,化学性质相似
难度: 简单查看答案及解析
-
具有相同原子数和价电子数的微粒之间互称等电子体,等电子体往往具有相似的空间构型,以下各组粒子不能互称为等电子体的是( )
A. CO和N2 B. N2H4和C2H4 C. O3和SO2 D. CO2和N2O
难度: 中等查看答案及解析
-
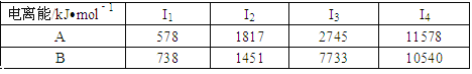
已知X、Y是主族元素,I为电离能,单位是kJ/mol。根据下表所列数据判断,错误的是
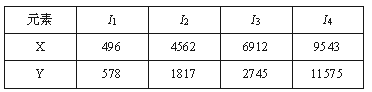
A. 元素X的常见化合价是+1价
B.元素Y是IIIA族元素
C.元素X与氯形成化合物时,化学式可能是XCl
D.若元素Y处于第三周期,它可与冷水剧烈反应
难度: 中等查看答案及解析
-
X是核外电子数最少的元素,Y是地壳中含量最多的元素,Z在地壳中的含量仅次于Y,W可以形成自然界最硬的原子晶体。下列叙述错误的是( )
A.WX4是沼气的主要成分
B.固态X2Y是分子晶体
C.ZW是原子晶体
D.ZY2的水溶液俗称“水玻璃”
难度: 简单查看答案及解析
-
下列关于晶体的说法一定正确的是( )

(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶点)
A. 分子晶体中都存在共价键
B. CaTiO3晶体中每个Ti4+和12个O2-相紧邻
C. SiO2晶体中每个硅原子与两个氧原子以共价键相结合
D. 金属晶体的熔点都比分子晶体的熔点高
难度: 中等查看答案及解析
-
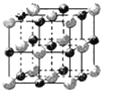
某固体仅由一种元素组成,其密度为5.0 g·cm-3,用X射线研究该固体的结构时得知:在边长10-7 cm的正方体中含有20个原子,则此元素的相对原子质量最接近下列数据中的( )
A.32 B.120 C.150 D.180
难度: 简单查看答案及解析
-
能与氢氧化钠溶液反应且属化合物的原子晶体是( )
A. 铝 B. 金刚石 C. 硅 D. 二氧化硅
难度: 中等查看答案及解析
-
利用晶体结构,可以用来解释( )
A. 晶体有规则的几何外形,非晶体没有规则的几何外形
B. 晶体有一定的熔点,非晶体没有一定的熔点
C. 晶体的导电性能比非晶体好
D. 晶体的各向异性
难度: 困难查看答案及解析
-
下列叙述中正确的是( )
A. 能电离出H+的化合物除水外都是酸,分子中含有几个氢原子它就是几元酸
B. 无机含氧酸分子中含有几个羟基,它就属于几元酸
C. 同一元素的含氧酸,该元素的化合价越高,其酸性越强,氧化性也越强
D. H3PO4和H2CO3分子中非羟基氧的个数均为1,但它们的酸性不相近,H3PO4是中强酸而H2CO3是弱酸
难度: 中等查看答案及解析
-
如图所示晶体结构是一种具有优良的电压、电光等功能的晶体材料的最小结构单元(晶胞).晶体内与每个“Ti”紧邻的氧原子数和这种晶体材料的化学式分别是(各元素所带电荷均已略去)( )
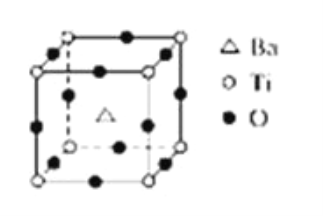
A. 8;BaTi8O12
B. 8;BaTi4O9
C. 6;BaTiO3
D. 3;BaTi2O3
难度: 中等查看答案及解析
-
如图所示是从NaCl或CsCl晶体结构中分割出来的部分结构图,其中属于从NaCl晶体中分割出来的结构图是( )

A. (1)和(3) B. (2)和(3) C. (1)和(4) D. 只有(4)
难度: 中等查看答案及解析
 ____________________;
____________________; ____________________。
____________________。