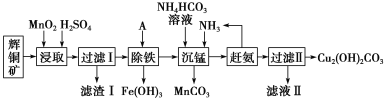
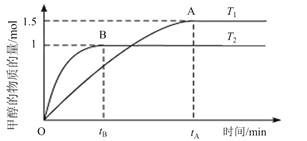
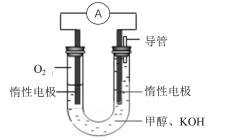
-
中国传统文化源远流长,对人类文明贡献巨大,下列说法不正确的是
A. “熬胆矾铁釜,久之亦化为铜”,该过程发生了氧化还原反应
B. “试玉要烧三日满,辨材须待七年期”中“玉”的成分是硅酸盐,该句诗表明玉的熔点很高
C. “蘸梦羊毫, 耕耘累累;开春猴棒,再拓涓涓”制作毛笔的羊毛是属于蛋白质
D. “青蒿一握,以水二升渍,绞取汁”,该方法提取青蒿素的过程属于化学变化
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是
①1 L 0.1 mol·
NH4Cl溶液中,
的数量为0.1 NA
②0.1 mol H2和0.1 mol I2于密闭容器中充分反应后,其分子总数为0.2 NA
③标准状况下,22.4 L二氯甲烷的共价键数为7NA个
④一定条件下,2 mol SO2和1 mol O2混合在密闭容器中充分反应后容器中的分子数大于2 NA
⑤31g白磷P4中含P—P单键数目为6NA
⑥2 mL 0.5 mol/L FeCl3溶液滴入沸水中制备Fe(OH)3胶体,所得胶粒数目小于0.001 NA
A. ①④⑥ B. ②④⑥ C. ②④⑤ D. ②③⑥
难度: 中等查看答案及解析
-
前20号主族元素W、X、Y、Z的原子序数依次增加。W的最外层电子数是内层电子数的3倍,W、X、Z最外层电子数之和为10;W与Y同族。下列说法不正确的是
A. W的氢化物沸点大于Y的氢化物沸点
B. 简单离子半径:X > W
C. Z的氢化物中含离子键
D. 最高价氧化物对应水化物的碱性:Z > X
难度: 中等查看答案及解析
-
下列离子方程式的书写及评价均合理的是( )
选项
离子方程式
评价
A
将2 mol Cl2通入含1 mol FeI2的溶液中:
2Fe2++2I-+2Cl2===2Fe3++4Cl-+I2
正确;Cl2过量,可将Fe2+、I-均氧化
B
Ba(HCO3)2溶液与足量的NaOH溶液反应:
Ba2++HCO3-+OH-===BaCO3↓+H2O
正确;酸式盐与碱反应生成正盐和水
C
过量SO2通入NaClO溶液中:
SO2+H2O+ClO-===HClO+HSO3-
正确;说明酸性:H2SO3强于HClO
D
1 mol/L的NaAlO2溶液和2.5 mol/L的HCl溶液等体积混合:
2AlO2-+5H+===Al3++Al(OH)3↓+H2O
正确;第一步反应和第二步反应消耗的H+的物质的量之比为2∶3
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
据报道以二氧化碳为原料采用特殊的电极电解强酸性的二氧化碳水溶液可得到多种燃料,其原理下图所示,该装置工作时,下列叙述错误的是
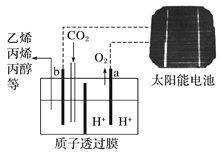
A. b极上生成乙烯的电极反应式为:2CO2+12H++12e-===C2H4+4H2O
B. a接太阳能电池的正极
C. a级上发生还原反应生成标况下22.4 L氧气时,电路中转移的电子数为4NA
D. 溶液中H+通过质子透过膜向b极移动
难度: 中等查看答案及解析
-
我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。
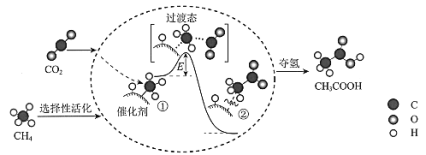
下列说法不正确的是
A. 生成CH3COOH总反应的原子利用率为100%
B. 该催化剂可有效提高反应物的平衡转化率
C. ①→②放出能量并形成了C-C键
D. CH4→CH3COOH过程中,有C-H键发生断裂
难度: 中等查看答案及解析
-
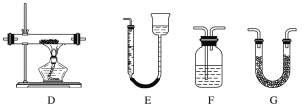
下列实验能达到实验目的的是
选项
实验操作
实验目的
A
F2、I2分别与H2反应
比较氟、碘的非金属性强弱
B
向MgCl2、AlCl3溶液中分别通入NH3
比较镁、铝的金属性强弱
C
测定相同浓度的Na2CO3、Na2SO3溶液的pH
比较碳、硫的非金属性强弱
D
向某溶液中加入盐酸,将生成的气体通入品红溶液中
检验溶液中是否含有SO32-
A. A B. B C. C D. D
难度: 中等查看答案及解析