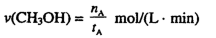-
科学家利用太阳能分解水生成的氢气在催化剂作用下 与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知:H2(g)、CO(g)和CH3OH(1)的燃烧热△H分别为-285.8 kJ .
. 、一283.0 kJ
、一283.0 kJ 和一726.5.kJ
和一726.5.kJ 。请回答下列问题:
。请回答下列问题:
(1)用太阳能分解10mol H2O(1)消耗的能量是________kJ.
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为:
__________________________________________________________________________.
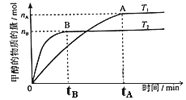
(3)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,
考查温度对反应的影响,实验结果如下图所示(注: 、
、 均大于300℃):
均大于300℃):
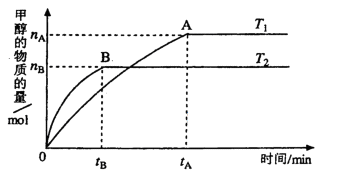
下列说法正确的是_______________(填序号)
①温度为 时,从反应开始到反应达到平衡,生成甲醇的平均速率为:
时,从反应开始到反应达到平衡,生成甲醇的平均速率为:
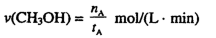
②该反应在 时的平衡常数比
时的平衡常数比 时的小
时的小
③该反应为放热反应
④处于A点的反应体系的温度从 变到
变到 ,达到平衡时
,达到平衡时 增大
增大
(4)在 温度时,将1mol CO2和3mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO2的转化率为a,则此时容器内的压强与起始压强之比为___________。
温度时,将1mol CO2和3mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO2的转化率为a,则此时容器内的压强与起始压强之比为___________。
(5)在直接以甲醇为燃料的燃料电池中,电解质溶液为酸性,负极的反应式为___________________;正极的反应式为_____________________________________.理想状态下,该燃料电池消耗lmol甲醇所能产生的最大电能为701.8kJ,则该燃料电池的理论效率为_______________(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比)。
-
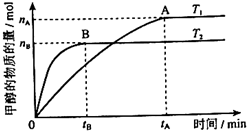
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.请回答下列问题:
(1)用太阳能分解10mol水消耗的能量是______kJ;
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为______;
(3)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);下列说法正确的是______(填序号)
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH)= mol•L-1•min-1
mol•L-1•min-1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时 增大
增大
(4)在T1温度时,将1molCO2和3molH2充入一密闭恒容容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为______;
(5)在直接以甲醇为燃料的燃料电池中,电解质溶液为酸性,负极的反应式为______,正极的反应式为______.理想状态下,该燃料电池消耗1mol甲醇所能产生的最大电能为702.1kJ,则该燃料电池的理论效率为______(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比).
-
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H2(g)、CO(g)和CH3OH(l)的燃烧热分别为285.8kJ·mol-1、283.0kJ·mol-1和726.5kJ·mol-1。回答下列问题:
(1)用太阳能分解100g水消耗的能量是_______kJ。
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为____________。
(3)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变得情况下,考察温度对反应的影响,实验结果如图所示(注:T1、T2均大于300℃);下列说法正确的是________(填序号)。
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH)= mol·L-1·min-1
mol·L-1·min-1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时 增大
增大
(4)在T1温度时,将1molCO2和3molH2充入一密闭恒容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为___________。
(5)在直接以甲醇为燃料电池中,电解质溶液为酸性,负极的反应式为_____________。理想状态下,该燃料电池消耗1molCH3OH所能产生的最大电能为702.1kJ,则该燃料电池的理论效率为___________(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比)。
-
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.请回答下列问题:
(1)用太阳能分解10mol水消耗的能量是______kJ;
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为______;
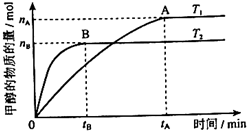
(3)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);下列说法正确的是______(填序号)
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH)= mol•L-1•min-1
mol•L-1•min-1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时 增大
增大
(4)在T1温度时,将1molCO2和3molH2充入一密闭恒容容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为______;
(5)在直接以甲醇为燃料的燃料电池中,电解质溶液为酸性,负极的反应式为______,正极的反应式为______.理想状态下,该燃料电池消耗1mol甲醇所能产生的最大电能为702.1kJ,则该燃料电池的理论效率为______(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比).
-
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.请回答下列问题:
(1)用太阳能分解10mol水消耗的能量是______kJ;
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为______;
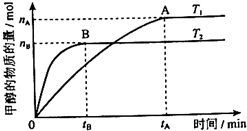
(3)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);下列说法正确的是______(填序号)
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH)= mol•L-1•min-1
mol•L-1•min-1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时 增大
增大
(4)在T1温度时,将1molCO2和3molH2充入一密闭恒容容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为______;
(5)在直接以甲醇为燃料的燃料电池中,电解质溶液为酸性,负极的反应式为______,正极的反应式为______.理想状态下,该燃料电池消耗1mol甲醇所能产生的最大电能为702.1kJ,则该燃料电池的理论效率为______(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比).
-
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1。请回答下列问题:
(1)用太阳能分解10mol水消耗的能量是_____________kJ;
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_____________;
(3)在溶积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变得情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);
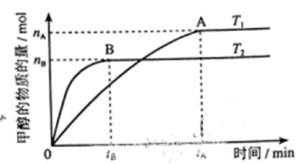
下列说法正确的是________(填序号)
① 温度为T1时,从反应开始到平衡,生成甲醇的平均速率为
v(CH3OH)=  mol·L-1·min-1
mol·L-1·min-1
②该反应在T时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时 增大
增大
(4)在T1温度时,将1molCO2和3molH2充入一密闭恒容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为______;
(5)在直接以甲醇为燃料电池中,电解质溶液为酸性,负极的反应式为________、正极的反应式为________。理想状态下,该燃料电池消耗1mol甲醇所能产生的最大电能为702.1kj,则该燃料电池的理论效率为________(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比)
-
(12分) 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1。请回答下列问题:
(1)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_____________;
(2)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变得情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);
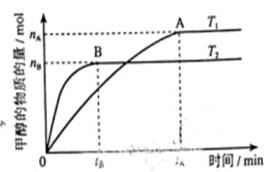
下列说法正确的是________(填序号,错选倒扣分)
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为:
v(CH3OH)=nA /tAmol·L-1·min-1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时 增大
增大
(3)在T1温度时,将1molCO2和3molH2充入一密闭恒容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为______;
(4)在直接以甲醇为燃料电池中,电解质溶液为酸性,负极的反应式为________。理想状态下,该燃料电池消耗1mol甲醇所能产生的最大电能为702.1kJ,则该燃料电池的理论效率为________(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比)
-
(14分)
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1。请回答下列问题:
(1)用太阳能分解10mol水消耗的能量是_____________kJ;
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_____________;
(3)在溶积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变得情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);
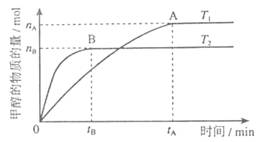
下列说法正确的是________(填序号)
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为
v(CH3OH)=  mol·L-1·min-1
mol·L-1·min-1
②该反应在T时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时 增大
增大
(4)在T1温度时,将1molCO2和3molH2充入一密闭恒容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为______;
(5)在直接以甲醇为燃料电池中,电解质溶液为酸性,负极的反应式为________、正极的反应式为________。理想状态下,该燃料电池消耗1mol甲醇所能产生的最大电能为702.1kJ,则该燃料电池的理论效率为________(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比)
-
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知在常温常压下:
①2CH3OH(l) + 3O2 (g) = 2CO2(g) + 4H2O(g) ∆H1= – 1276.0 kJ/mol
②2H2(g) + O2(g) = 2H2O(g) ∆H2 = – 482.0 kJ/mol;
③H2O(g) = H2O(l) ∆H3= – 44.0 kJ/mol
(1)写出由CO2和H2合成甲醇和液态水的热化学方程式______________________。
(2)在容积为2 L的密闭容器中,通入2mol CO2和5mol H2合成甲醇,在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示;
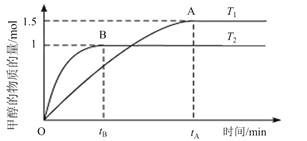
①T1 ______T2(填“<,>或=”),处于A点的反应体系从T1变到T2,达到平衡时 _______(填“增大,减小或不变”)。
_______(填“增大,减小或不变”)。
②若在T2温度下5 min达到化学平衡,求平衡时用H2表示的平均反应速率为 ______。
______。
(3)某实验小组依据甲醇燃烧的反应原理,设计下图所示的电池装置:
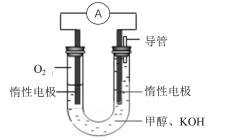
①写出电池负极的电极反应式:_____________________________________,该电池工作一段时间,测得溶液的pH________(填“增大,减小或不变”)。
②写出该电池总反应的离子方程式为________________________________________。
-
(11分)科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1。请回答下列问题:
(1)用太阳能分解10mol水消耗的能量是_____________kJ;
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_____________;
(3)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);
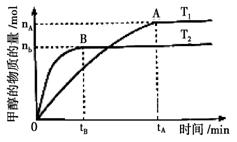
下列说法正确的是______(填序号)
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为
v(CH3OH)=nA/tA mol·L-1·min-1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应
 ④处于A点的反应体系从T1变到T2,
④处于A点的反应体系从T1变到T2,
达到平衡时增大
(4)在T1温度时,将1molCO2和3molH2充入一密闭恒容容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为______;
(5)在直接以甲醇为燃料电池中,电解质溶液为酸性,负极的反应式为________、正极的反应式为________。理想状态下,该燃料电池消耗1mol甲醇所能产生的最大电能为702.1KJ,则该燃料电池的理论效率为________(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比)

_______(填“增大,减小或不变”)。
______。