-
下列有关物质的分类或归纳的说法正确的是( )
A. 漂白粉、水玻璃、福尔马林都是混合物
B. 乙烯、油脂、纤维素、光导纤维都属于高分子化合物
C. PM2.5(微粒直径约为2.5×10-6m)分散在空气中形成气溶胶,能产生丁达尔效应
D. 纯碱、氨水、蔗糖分别属于强电解质、弱电解质和非电解质
难度: 简单查看答案及解析
-
化学与社会、生活密切相关。下列有关说法错误的是( )
A. 实施“煤改气”、“煤改电”等清洁燃料改造工程,有利于保护环境
B. 臭氧的还原性使细菌的蛋白质变性
C. “地沟油”经过加工处理后可用来制肥皂
D. 光化学烟雾是碳氢化合物和氮氧化合物在太阳光(紫外线)作用下发生光化学反应生成的二次污染物
难度: 简单查看答案及解析
-
现有氧化还原反应:①2Br-+ Cl2===Br2+2Cl-;②2Fe2++Br2===2Fe3++2Br-;③2MnO4-+10Cl-+16H+===2Mn2++5Cl2↑+8H2O。根据上述反应,判断下列结论正确的是( )
A. 还原性强弱顺序为Fe2+>Br->Mn2+>Cl-
B. 反应①中Cl-是Cl2的氧化产物,反应③中Cl2是 Cl- 的还原产物
C. 若向酸性KMnO4溶液中加入FeSO4溶液,可观察到溶液紫红色褪去
D. 1 mol Cl2通入含1 mol FeBr2的溶液中,离子反应为3Cl2+2Fe2++4Br-===2Br2+6Cl-+2Fe3+
难度: 困难查看答案及解析
-
下列有关化学用语表示正确的是
A. H2S的电子式:
B. 对硝基甲苯:
C. 氧离子的结构示意图:
D. 质子数为53,中子数为74的碘原子:
I
难度: 简单查看答案及解析
-
下列与阿伏加德罗常数的值( NA)有关的说法正确的是
A. 在标准状况下,2.24L水中含有氢原子的数目为2NA
B. 8.0 g Cu2S和CuO的混合物中含有铜原子数为0.1NA
C. 在密闭容器中加入0.5 mol N2和1.5 mol H2,充分反应后可得到NH3分子数为NA
D. 2.3 g Na与氧气完全反应,反应中转移的电子数在0.1NA~0.2NA之间
难度: 中等查看答案及解析
-
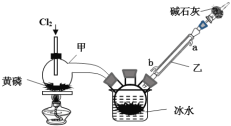
实验室将NH3通入AlCl3溶液中制备Al(OH)3,经过滤、洗涤、灼烧后得到Al2O3,下列图示装置和原理均合理的是( )
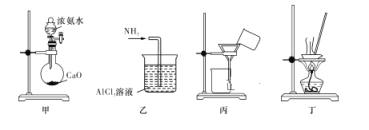
A. 用装置甲制取 NH3
B. 用装置乙制备 Al(OH)3
C. 用装置丙过滤并洗涤 Al(OH)3
D. 用装置丁灼烧 Al(OH)3得到Al2O3
难度: 简单查看答案及解析
-
甲乙丙丁戊是中学常见的无机物,他们的转化关系如图所示(某些条件和部分产物已略去)。下列说法错误的是

A. 若戊为一种强碱且焰色反应为黄色,则反应①②可能都属于氧化还原反应
B. 常温下,若丙为无色气体,戊为红棕色气体,则甲、乙可能是铜和稀硝酸
C. 若甲为硫磺燃烧产物,丁为水,则戊不可用于干燥甲
D. 若甲为浓盐酸,乙为MnO2,则戊可能使品红褪色
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A. 硅酸钠溶液与盐酸的反应:Na2SiO3+2H+===H2SiO3↓+2Na+
B. 用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O===3I2+6OH-
C. 饱和Na2CO3溶液与CaSO4固体反应:CO32−+CaSO4
CaCO3+SO42−
D. 向NaHCO3溶液中滴加少量Ba(OH)2溶液:Ba2++OH-+HCO3—===BaCO3↓+H2O
难度: 中等查看答案及解析
-
短周期主族元素R、W、X、Y、Z的原子序数依次增大,R的简单氢化物可用作制冷剂,X是短周期中金属性最强的元素。Y的简单离子在同周期元素的简单离子中半径最小,由W、X和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀(Z的单质)析出,同时产生有刺激性气味的气体(Z的氧化物)。下列说法正确的是( )
A. 原子半径:Z>Y>X>W
B. Z的简单氢化物的热稳定性比W的强
C. Y的氧化物既可溶于R的最高价氧化物对应的水化物水溶液,也可溶于R的氢化物水溶液
D. X与W、Z形成的化合物不少于三种
难度: 中等查看答案及解析
-
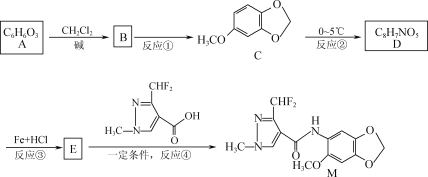
CMU是一种荧光指示剂,可通过下列反应制备:
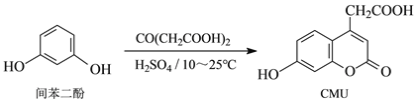
下列说法正确的是( )
A. 1molCMU最多可与1molBr2反应
B. 1molCMU最多可与3molNaOH反应
C. 可用FeCl3溶液鉴别间苯二酚和CMU
D. CMU在酸性条件下的水解产物只有1种
难度: 中等查看答案及解析
-
孔雀石的主要成分是Cu2(OH)2CO3(含Fe2O3、FeCO3、Al2O3、SiO2杂质),工业上用孔雀石制备硫酸铜的第一步需用过量的硫酸溶解并过滤。常温下,分别取滤液并向其中加入指定物质,反应后的溶液中大量存在的离子组正确的是
A. 加入过量氨水:Fe3+、NH4+、SO42-、OH-
B. 加入过量NaClO溶液:Fe2+、Na+、ClO-、SO42-
C. 加入过量NaOH溶液:Na+、AlO2-、SO42-、OH-
D. 加入过量NaHCO3溶液:Na+、Al3+、SO42-、HCO3-
难度: 中等查看答案及解析
-
如下图所示,其中甲池的总反应式为2CH3OH + 3O2 + 4KOH===2K2CO3 + 6H2O,下列说法正确的是( )
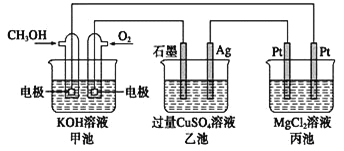
A. 甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置
B. 甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O===CO32-+ 8H+
C. 甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45 g固体
D. 反应一段时间后,向乙池中加入一定量Cu(OH)2固体能使CuSO4溶液恢复原浓度
难度: 中等查看答案及解析
-
80℃时,NO2(g)+SO2(g)
SO3(g)+NO(g)。该温度下,在甲、乙、丙三个体积相等且恒容的密闭容器中,投入NO2和SO2,起始浓度如下表所示,其中甲经2 min达平衡时,NO2的转化率为50%,下列说法正确的是
起始浓度
甲
乙
丙
c(NO2)/(mol·L-1)
0.10
0.20
0.20
c(SO2)/(mol·L-1)
0.10
0.10
0.20
A. 容器甲中的反应在前2 min的平均速率v(SO2)=0.10 mol·L-1·min-1
B. 达到平衡时,容器丙中正反应速率与容器甲相等
C. 温度升至90℃,上述反应平衡常数为1.56,则反应的ΔH>0
D. 容器乙中若起始时改充0.10 mol·L-1NO2和0.20 mol·L-1SO2,达到平衡时c(NO)与原平衡相同
难度: 中等查看答案及解析
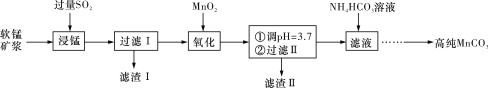
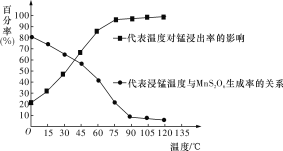
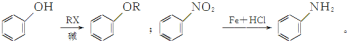
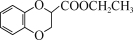 ,写出制备的合成路线流程图(无机试剂任用)_____。
,写出制备的合成路线流程图(无机试剂任用)_____。