-
化学与人类生活、生产和社会可持续发展密切相关。下列说法不正确的是
A. 铵态氮肥和草木灰混合使用会降低肥效
B. 若电工操作中将铝线与铜线直接相连,会导致铜线更快被氧化
C. 用K2FeO4代替Cl2处理饮用水,既能杀菌又能净水
D. 工业生产上不能采取加压措施提高SO2转化为SO3的转化率
难度: 中等查看答案及解析
-
下列化学用语的表述正确的是
A. NH4Cl的水解常数表达式:K=
B. NaHCO3水解的离子方程式:HCO3-+H2O
H3O++CO32-
C. 结构示意图为
的阴离子都不能破坏水的电离平衡
D. H2SO3的电离方程式:H2SO3
2H++SO32-
难度: 中等查看答案及解析
-
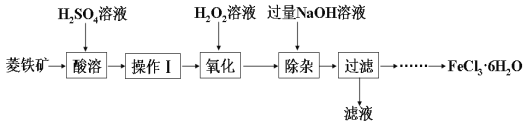
孔雀石的主要成分是Cu2 (OH)2CO3(含Fe2O3、FeCO3、Al2O3、SiO2杂质),工业上用孔雀石制备硫酸铜的第一步需用过量的硫酸溶解并过滤。常温下,分别取滤液并向其中加入指定物质,反应后的溶液中可以大量存在的一组离子正确的是
A. 加入过量氨水:Fe3+、NH4+、SO42-、OH-
B. 加入过量NaNO3溶液:Fe2+、NO3-、Cu2+、SO42-
C. 加入过量NaOH溶液:Na+、AlO2-、SO42-、OH-
D. 加入过量NaHCO3溶液:Na+、Al3+、SO42-、HCO3-
难度: 困难查看答案及解析
-
下列有关物质性质与用途具有对应关系正确的是
A. 氯化钠溶液显中性,可用铝制容器贮存氯化钠溶液
B. 氢氧化镁分解时吸收大量的热量,添加到合成树脂中可作阻燃剂
C. 碳酸钠溶液具有碱性,可用于治疗胃酸过多
D. 氯化铁溶液呈酸性,可用于蚀刻铜电路板
难度: 中等查看答案及解析
-
硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示)。下列说法错误的是

A. 碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂
B. 为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
C. 可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D. 常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大
难度: 中等查看答案及解析
-
巧妙的实验设计有助于更好地解决问题。下列装置不能达到实验目的的是
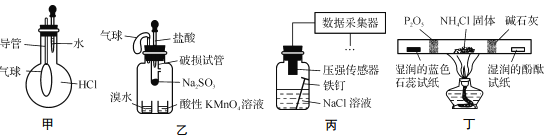
A. 用装置甲验证HCl气体易溶于水
B. 用装置乙验证SO2具有漂白性
C. 用装置丙采集到的压强数据判断铁钉发生析氢腐蚀还是吸氧腐蚀
D. 用装置丁检验NH4Cl分解产生的气体
难度: 中等查看答案及解析
-
在给定条件下,下列选项所示的物质间转化均能实现的是
A. MgCO3
MgCl2(aq)
Mg
B. H2SO4(浓)
SO2
BaSO3(s)
C. NaAlO2
AlCl3(aq)
AlCl3(s)
D. NaCl(aq)
NaHCO3
Na2CO3
难度: 中等查看答案及解析
-
下列指定反应的离子方程式书写不正确的是
A. 用铜电极电解MgCl2溶液:Mg2++2Cl-+2H2O
Mg(OH)2↓+Cl2↑+H2↑
B. 饱和碳酸钠溶液中通入足量的二氧化碳:2Na++CO32-+CO2+H2O=2NaHCO3↓
C. 向Ba(OH)2溶液中加入NaHSO4至溶液为中性:Ba2++2OH-+2H++
BaSO4↓+2H2O
D. 酸性介质中KMnO4氧化H2O2:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O
难度: 中等查看答案及解析
-
下列实验操作不正确的是
A. 配制AlCl3溶液时,在溶液中滴加几滴稀盐酸
B. 探究温度对化学平衡移动的影响:将盛有NO2和N2O4混合气体的烧瓶,先后置于冷水和热水中,观察烧瓶中气体颜色的变化
C. 在pH试纸上分别滴加等浓度的CH3COONa、NaClO溶液,比较两者的水解程度的大小
D. 锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去
难度: 中等查看答案及解析
-
一种钌(Ru)基配合物光敏染料敏化太阳能电池的原理及电池中发生的主要反应如下图所示,下列说法不正确的是
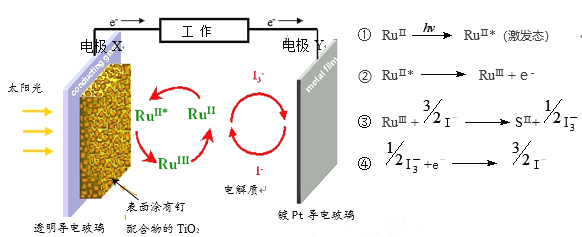
A. X极为电池的负极 B. 电池工作时,光能转变为电能
C. 电池工作时,Y极上发生还原反应 D. 电池的电解质溶液中I-和I3-的浓度不断减少
难度: 中等查看答案及解析
-
下列图示与对应的叙述相符的是

A. 图1表示1 LpH=2的CH3COOH溶液加水稀释至V L,pH随lgV的变化
B. 图2表示不同温度下水溶液中H+和OH-浓度的变化的曲线,图中温度T2>T1
C. 图3表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率小于b点
D. 图4表示同一温度下,在不同容积的容器中进行反应2BaO2(s)
2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
难度: 困难查看答案及解析
-
下列有关说法正确的是
A. 298 K时,2H2S(g)+SO2(g)===3S(s)+2H2O(l)能自发进行,则其ΔH>0
B. 氨水稀释后,溶液中c(NH4+)/c(NH3·H2O)的值减小
C. 电解精炼铜过程中,阳极质量的减少与阴极质量的增加一定相等
D. 25℃时Ka(HClO)=3.0×10−8,Ka(HCN)=4.9×10−10,若该温度下NaClO溶液与NaCN溶液的pH相同,则c(NaClO)>c(NaCN)
难度: 中等查看答案及解析