-
可用于电动汽车的铝-空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极.下列说法正确的是( )
A.以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-=4OH-
B.以NaOH溶液为电解液时,负极反应为:Al+3OH--3e-=Al(OH)3↓
C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变
D.电池工作时,电子通过外电路从正极流向负极难度: 中等查看答案及解析
-
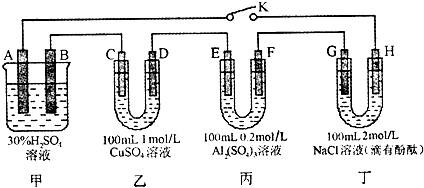
研究物质性质的方法很多,其中对照实验就是一种重要的方法,下列装置不是作为对照实验的是( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.实验中需用2.0 mol•L-1的Na2 CO3溶液950 mL,配制时应选用的容量瓶的规格和用托盘天平称取Na2CO3的质量分别为1000mL,201.4 g
B.1L 0.5mol•L-1稀硫酸与1L 1mol•L-1氢氧化钠溶液反应放出57.3kJ的热化学方程式为:H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(1)△H=-114.6kJ/mol
C.向SO2水溶液中滴加盐酸酸化的BaCl2溶液,有白色沉淀生成,说明BaSO3难溶于盐酸
D.浓、稀硝酸都能使蓝色石蕊试纸最终变为红色难度: 中等查看答案及解析
-
宁夏的硒砂瓜现今已享誉区内外,西瓜富含硒元素,有延年益寿、抗衰老、抗癌作用,因之得名“硒砂瓜”.二氧化硒(Se)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se.在回收过程当中涉及到如下两个化学反应
①SeO2+4KI+4HNO3=Se+2I2+4KNO3+2H2O;
②Se+2H2SO4(浓)=2SO2↑+□+2H2O
下列有关叙述正确的是( )
A.SeO2、H2SO4(浓)、I2的氧化性由强到弱的顺序是H2SO4(浓)>SeO2>I2
B.①中Se是氧化产物,I2是还原产物
C.反应②中方框中的物质为还原产物
D.反应①中每有0.6 mol I2生成,转移电子数目为2.4NA难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.7.8g Na2O2含有的阴离子数目为0.2NA
B.0.5mol雄黄(As4S4,结构如图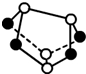 )含有5NA个S-S键
)含有5NA个S-S键
C.14g乙烯和丙烯(C3H6)的混合物中含有的原子数目为3NA
D.常温下,5.6g铁钉与足量浓硝酸反应,转移的电子数为0.3NA难度: 中等查看答案及解析
-
下列各组离子在指定溶液中能大量共存的是( )
①pH=11的溶液中:CO32-、Na+、AlO2-、NO3-
②无色溶液中:K+、Na+、MnO4-、SO42-
③加入Al能放出H2的溶液中:Cl-、HCO3-、SO42-、NH4+
④含有Fe2+的溶液中:[Fe(CN)6]3-、NO3-、Cl-
⑤由水电离出的c(OH-)=1×10-13mol•L-1的溶液中:Na+、Ba2+、Cl-、Br-.
A.①⑤
B.②③
C.②④
D.③⑤难度: 中等查看答案及解析
-
下列化学反应的离子方程式正确的是( )
A.氢氧化亚铁溶于稀硝酸:Fe(OH)2+2H+=Fe2++2H2O
B.醋酸与NaHCO3溶液反应:H++HCO3-=CO2↑+H2O
C.向KI溶液中加入FeCl3溶液:2Fe3++2I-=2Fe2++I2
D.将铝片加入烧碱溶液中:2Al+2OH-+2H2O=2AlO2-+3H2↑难度: 中等查看答案及解析
-
将0.03mol Cl2缓缓通入含有0.02mol H2SO3和0.02mol HBr的混合溶液中,在此过程中C(H+)与Cl2用量的关系是( )
A.
B.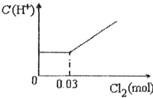
C.
D.
难度: 中等查看答案及解析
-
如图为元素周期表中短周期的一部分,关于Y、Z、M的说法正确的是( )

A.非金属性:Y>Z>M
B.离子半径:M->Z2->Y-
C.ZM2分子中各原子的最外层均满足8电子稳定结构
D.三种元素中,Y的最高价氧化物对应的水化物酸性最强难度: 中等查看答案及解析
-
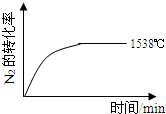
合成氨反应为:N2(g)+3H2(g)⇌2NH3(g).图1表示在一定的温度下此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线.图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响.下列说法正确的是( )
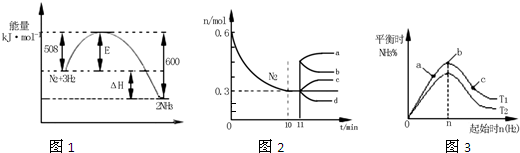
A.由图1可知2NH3(g)N2(g)+3H2(g)△H=-92kJ•mol-1
B.图2中0~10min内该反应的平均速率v(H2)=0.045mol•L-1•min-1,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为d
C.图3中a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是b点
D.图3中T1和T2表示温度,对应温度下的平衡常数为K1、K2,则:T1>T2,K1>K2难度: 中等查看答案及解析
-
25℃时,用0.1000mol/L NaOH溶液滴定20.00mL 0.1000mol/L CH3COOH溶液所得滴定曲线如图.下列叙述正确的是( )

A.点①所示溶液:c(CH3COO-)+c(CH3COOH)=c(Na+)
B.点②所示溶液:c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
C.点③所示溶液:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D.滴定终点时:c(CH3COOH)+c(CH3COO-)=c(Na+)难度: 中等查看答案及解析
-
4molA和2molB放入2L密闭容器中发生反应2A(g)+B(g)⇌2C(g),△H<0.4s后反应达到平衡状态,此时测得C的浓度为0.6mol/L.下列说法正确的是( )
A.4s内,v(B)=0.075mol/
B.当c(A):c(B):c(C)=2:1:2时,该反应即达到平衡状态
C.达到平衡状态后,若只升高温度,则C的物质的量浓度增大
D.达到平衡状态后,若温度不变,缩小容器的体积,则A的转化率降低难度: 中等查看答案及解析
-
铁和氧化铁的混合物共x mol,加盐酸后固体全部溶解,共收集到y mol氢气,且向反应后的溶液中加入KSCN溶液不显红色,则原混合物中铁的物质的量为( )
A.(x+y)mol
B.(x-y)mol
C.(x-y)mol
D.(x+y)mol难度: 中等查看答案及解析
-
2011年9月23日,中国科学家屠呦呦获得了美国拉斯克医学奖的临床医学奖,获奖理由是“因为发现青蒿素--一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命”.如图是青蒿素的结构,则有关青蒿素的说法中不正确的是( )
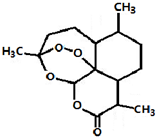
A.青蒿素分子式为C15H22O5
B.青蒿素易溶于水、乙醇、苯
C.青蒿素有-O-O-键具有较强的氧化性
D.青蒿素在碱性条件下易发生水解反应难度: 中等查看答案及解析
-
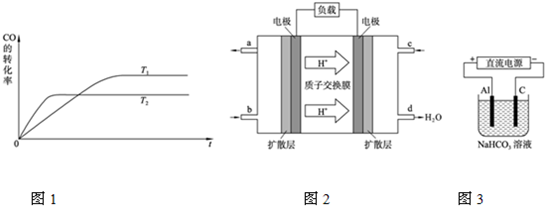
高温下,某反应达到平衡,平衡常数K=
.恒容时,温度升高,H2的浓度减小.下列说法正确的是( )
A.该反应的化学方程式为CO+H2O=CO2+H2
B.升高温度,逆反应速率减小
C.该反应的焓变为正值
D.恒温恒容时,增大压强,H2的浓度一定减小难度: 中等查看答案及解析
-
已知热化学方程式C2H2(g)+
O2(g)=2CO2(g)+H2O(g);△H=-1256kJ/mol,下列说法正确的是( )
A.乙炔的燃烧热为1256kJ/mol
B.若转移10mol电子,则消耗2.5mol O2
C.若生成2mol液态水,则△H=-2512kJ/mol
D.若形成4mol碳氧共用电子对,则放出的热量为2512kJ难度: 中等查看答案及解析