-
下列反应中符合离子反应 H++OH-=H2O 的是
A. 稀硫酸与稀氨水 B. 稀硫酸与氢氧化钡溶液
C. 浓硝酸与氢氧化钡溶液 D. 盐酸与氢氧化铁胶体反应
难度: 中等查看答案及解析
-
随着科学技术的发展,新材料层出不穷,下列不属于合金材料的是
A. 304不锈钢炊具 B. 现行流通的1元硬币
C. 古代的司母戊鼎 D. 秦皇陵墓模拟江湖的水银
难度: 简单查看答案及解析
-
钠元素广泛存在于自然界,中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700℃时制造出纳米级金刚石粉末。该成果发表在世界权威的《科学》杂志上,立刻被科学家们高度评价为“稻草变黄金”。下列关于含钠元素物质的说法错误的是
A. “稻草变黄金”的过程中元素种类没有改变
B. NaCl与Na2CO3灼烧时火焰颜色相同
C. 治疗胃酸过多可以用NaHCO3,糕点生产也可以用NaHCO3
D. 金属钠放置空气中,最终会变成Na2O2
难度: 简单查看答案及解析
-
下列有关实验操作错误的是
A. 分液漏斗、容量瓶、锥形瓶使用前都需要检查是否漏液
B. 做实验剩余的钠可以放回原试剂瓶
C. 做焰色反应时,铂丝可以换成洁净铁丝并且用盐酸洗净再灼烧至火焰接近无色
D. 蒸馏烧瓶以及烧杯加热时都需要垫石棉网
难度: 简单查看答案及解析
-
《开宝本草》中记载了如何提取硝酸钾:“此即地霜也,所在山泽,冬月地上有霜,扫取以水临汁后,乃煎炼而成”。文中对硝酸钾的提取没有涉及的操作及方法是
A. 溶解 B. 蒸发 C. 结晶 D. 萃取
难度: 简单查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 0.1 mol/L K2SO4溶液中含有K+数目为 0.2NA
B. 将1 mL 5 mol/L的FeCl3溶液滴入100 mL沸水并继续煮沸至液体呈红褐色,所得分散系含胶粒数为0.005NA
C. 常温常压下,1.56 g Na2O2含有阴离子个数为0.02NA
D. 28 g铁粉与高温水蒸气反应,生成H2数目为0.5NA
难度: 简单查看答案及解析
-
下列关于气体说法正确的是
A. 当NA个O2所占的体积约为22.4 L时,说明该O2一定处于标准状况下
B. 1 mol H2和O2的混合气体在标准状况下的体积约为22.4 L
C. 稀有气体为单原子分子,在标准状况下,1 mol稀有气体的体积约为11.2 L
D. 1 mol H2的质量只有在标准状况下才等于2 g
难度: 简单查看答案及解析
-
下列有关胶体的说法错误的是
A. 氢氧化铁固体溶于盐酸可得澄清溶液与胶体性质无关
B. 制备氢氧化铁胶体的化学方程式是FeCl3+3H2O
Fe(OH)3↓+3HCl
C. 检验胶体能否透过滤纸的简便方法:用两张滤纸叠放,在上面滴几滴氢氧化铁胶体,看下层滤纸上是否出现红褐色
D. 氢氧化铁胶体粒子能吸附水中悬浮颗粒并沉降,从而达到净水目的
难度: 简单查看答案及解析
-
分类学习法是学习化学的一种重要方法,下列分类合理的是
A. NaHCO3和NaHSO4在水溶液中都能电离出H+,故都属于酸式盐
B. Na2CO3和NaOH的水溶液都能使酚酞显红色,故都属于碱
C. Fe2O3、FeO和Fe3O4都能与酸反应生成盐和水,故都属于碱性氧化物
D. CH4、NH3和H2O都是非金属氢化物,都不导电,故都属于非电解质
难度: 简单查看答案及解析
-
下列各组粒子在指定溶液中可能大量共存的是
A. 无色透明溶液中:Na+、Fe2+、Cl-、SO42-
B. c(Fe3+)=2.0 mol/L的溶液中:K+、Ca2+、SCN-、Cl-
C. 加入酚酞显红色的溶液中:Na+、CO32-、NO3-、K+
D. 加入铝粉能产生氢气的溶液中:Fe2+、NO3-、K+、SO42-
难度: 简单查看答案及解析
-
把一定量的铁粉投入氯化铁溶液中,完全反应后,所得溶液中Fe3+和Fe2+物质的量浓度之比为2:3,则已反应的Fe3+和未反应的Fe3+物质的量之比为
A. 1:1 B. 2:3 C. 2:1 D. 3:2
难度: 简单查看答案及解析
-
下列指定反应的离子方程式书写正确的是
A. 向FeSO4溶液中加入稀硫酸酸化的H2O2:Fe2++H2O2+2H+=Fe3++2H2O
B. 向CuSO4溶液中加少量Na2O2粉末:2Na2O2+2Cu2++2H2O=4Na++2Cu(OH)2+O2↑
C. 向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O
D. 用NaHCO3中和过多的胃酸:CO32-+2H+=CO2↑+H2O
难度: 简单查看答案及解析
-
常温下,在溶液中可以发生反应:Zn+2Fe3+=Zn2++2Fe2+,则下列叙述中①Zn被氧化;②Zn是氧化剂;③Zn具有还原性;④Fe2+是氧化产物;⑤Fe2+只有还原性;⑥Fe3+的氧化性比Zn2+的氧化性强,正确的是
A. ②④⑥ B. ①③④ C. ①③⑥ D. ③⑤⑥
难度: 简单查看答案及解析
-
根据反应:①Fe+Cu2+=Fe2++Cu
②2Fe3++Cu=Cu2++2Fe2+
③2Fe2++Cl2=2Fe3++2Cl﹣
④HClO+H++Cl﹣=Cl2↑+H2O
可以判断出各微粒的氧化性或还原性由强到弱的顺序正确的是
A. 氧化性:HClO>Cl2>Fe3+>Cu2+>Fe2+
B. 氧化性:Cl2>HClO>Fe3+>Cu2+>Fe2+
C. 还原性:Fe>Cu2+>Fe2+>Cl->Cl2
D. 还原性:Fe2+>Cu2+>Fe3+>Cl->Cl2
难度: 简单查看答案及解析
-
纳米科技已经从概念产品走向日常生活,Fe3O4的纳米颗粒制备可用离子方程式表示:3Fe2++2S2O32-+O2+4OH-=Fe3O4+S4O62-+2H2O 。下列说法正确的是
A. 该反应的氧化剂是S2O32-
B. 用一束可见光照射Fe3O4颗粒能发生丁达尔效应
C. 生成1 mol S4O62-转移4 mol电子
D. 1 mol O2参与反应时有3 mol Fe2+被氧化
难度: 简单查看答案及解析
-
将4.0 g NaOH和5.3 g Na2CO3混合并配成溶液,向溶液中逐滴缓慢滴加0.5 mol/L稀盐酸。下列图象能正确表示加入盐酸的体积和生成CO2的体积(标况下)的关系的是
A.
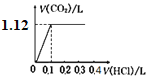 B.
B. 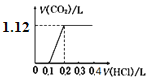
C.
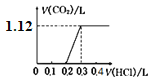 D.
D. 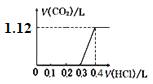
难度: 简单查看答案及解析