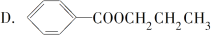-
下列离子方程式错误的是
A. 向Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2H++ SO42-=BaS04↓+2H2O
B. 酸性介质中KMnO4氧化 H2O2:2MnO4-+5H2O2+6H+= 2Mn2++5O2↑+ 8H2O
C. 等物质的量的MgCl2、Ba(OH)2和 HC1 溶液混合:Mg2++2OH-= Mg(OH)2↓
D. 铅酸蓄电池充电时的正极反应:PbSO4+ 2H2O-2e- = PbO2+4H++SO42-
难度: 中等查看答案及解析
-
常温下,下列有关离子共存的说法中正确的是( )
A. 某无色溶液中可能大量存在Al3+、NH4+、Cl—、SiO32—
B. 水电离出H+浓度为1×10-13 mol·L−1的澄淸透明溶液中可能大量存在Mg2+、Cu2+、SO42—、NO3—
C. 小苏打溶液中,可能大量存在I—、NO3—、Ba2+、ClO—
D. 使甲基橙呈红色的溶液中,可能大量存在NH4+、K+、AlO2— 、Cl—
难度: 中等查看答案及解析
-
X、Y、Z是原子序数依次递增的短周期元素,3 种元素的原子核外电子数之和与Ca2+的核外电子数相等,X、Z分别得到一个电子后均形成稀有气体原子的稳定电子层结构。下列说法正确的是
A. 原子半径:Z>Y>X
B. Z 与 X 形成化合物的沸点高于Z 的同族元素与 X形成化合物的沸点
C. CaY2 与水发生氧化还原反应时,CaY2只作氧化剂
D. CaX2、CaY2和CaZ2 等3种化合物中,阳离子与阴离子个数比均为 1∶2
难度: 中等查看答案及解析
-
下列有关物质的性质或应用的说法不正确的是
A. 二氧化硅是生产光纤制品的基本原料
B. 水玻璃可用于生产黏合剂和防火剂
C. 盐析可提纯蛋白质并保持其生理活性
D. 石油分馏可获得乙烯、丙烯和丁二烯
难度: 简单查看答案及解析
-
根据下列图像的叙述正确的是( )

A. 图(1)表示的热化学方程式为CO(g)+H2O(l)=CO2(g)+H2(g) ΔH= -41 kJ·mol-1
B. 图(2)表示的热化学方程式为CO(g)+H2O(g)=CO2(g)+H2(g) ΔH= +41 kJ·mol-1
C. 由图可知正、逆反应的热效应的数值相同
D. 两个图像表示的含义相同
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 第二周期元素随族序数的递增,其最高化合价也递增
B. 第ⅥA族元素的最简单氢化物中,稳定性最强的,其沸点也最高;
C. Fe(OH)3胶体做电泳实验时,由阴极区红色加深可知Fe(OH)3胶体带正电荷
D. 1mol H3PO3最多可与2 mol NaOH发生中和反应,但Na2HPO3属于酸式盐
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 高温下,0.2mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA
B. 室温下,1L pH=13的NaOH溶液中,由水电离的OH﹣离子数目为0.1NA
C. 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA
D. 5NH4NO3
2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数目为3.75NA
难度: 中等查看答案及解析
-
工业上常利用反应Cr2O7n-+CH3OH+H+→Cr3++CO2↑+H2O(未配平)来测定工业甲醇中甲醇的含量,下列说法中正确的是( )
A. 溶液的颜色从灰绿色变为橙色
B. Cr2O7n-发生氧化反应
C. 若配平后Cr3+和CO2的化学计量数比为2:1,则Cr2O7n-中的n=2
D. 若有3.2 g CH3OH参加反应,则转移的电子数为6.02×1022
难度: 中等查看答案及解析
-
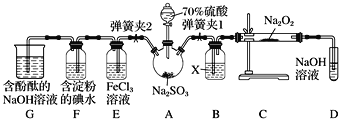
实验是化学研究的基础,关于下列各实验装置的叙述中正确的是
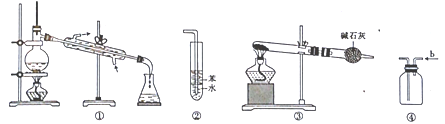
A. 装置①常用于分离互不相溶液体混合物
B. 装置②可用于吸收HCl气体,并防止倒吸
C. 以NH4HCO3为原料,装置③可用于实验室制备少量NH3
D. 装置④b口进气,用排空气法可收集CO2、NO等气体
难度: 中等查看答案及解析
-
下列事实不能用化学平衡移动原理解释的是( )
A. 合成氨工业中采用高压条件
B. 由H2、I2蒸气、HI组成的平衡体系加压后颜色变深
C. 用排饱和食盐水的方法收集Cl2
D. 在含有[Fe(SCN)]2+的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去
难度: 简单查看答案及解析
-
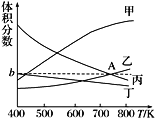
下列图示与对应的叙述相符的是
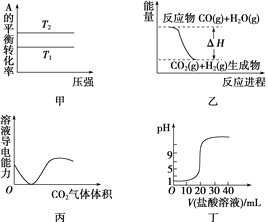
A. 由图甲可以判断:对于反应A(g)+B(g)
2C(g),若T1>T2,则ΔH<0
B. 图乙表示可逆反应CO(g)+H2O(g)
CO2(g)+H2(g) ΔH>0
C. 图丙表示CO2通入饱和Na2CO3溶液中,溶液导电性变化
D. 图丁表示0.1 mol·L-1的盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液pH随加入盐酸体积的变化
难度: 困难查看答案及解析
-
某温度下,在一个2L的密闭容器中,加人4molA和2molB进行如下反应:3A(g)+2B(g)
4C(?)+2D(?)反应一段时间后达到平衡,测得生成1.6molC,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是( )
A. 该反应的化学平衡常数表达式是K=c4(C)c2(D)/[c3(A)c2(B)]
B. 此时,B的平衡转化率是40%
C. 加压,平衡右移,化学平衡常数增大
D. 增加C,B的平衡转化率变小
难度: 中等查看答案及解析
-
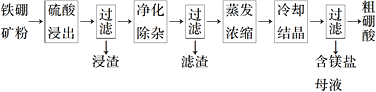
海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程,下列有关说法正确的是
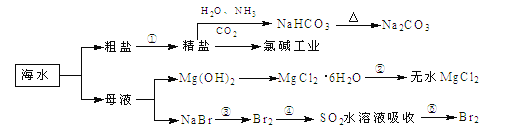
A. 制取NaHCO3的反应是利用其溶解度小于NaCl和NH4Cl
B. ①粗盐提纯中除去杂质离子Mg2+、Ca2+、SO42-时,必须先除Ca2+后除SO42-
C. 在工段③、④、⑤中,溴元素均被氧化
D. 工业上通过电解饱和MgCl2溶液制取金属镁
难度: 中等查看答案及解析
-
由下列实验现象一定能得出相应结论的是
选项
A
B
C
D
装置图
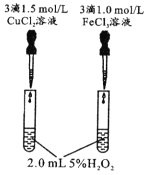
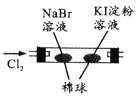
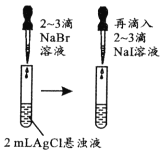
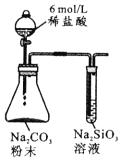
现象
右边试管产生气泡较快
左边棉球变棕黄色,右边棉球变蓝色
试管中先出现淡黄色固体,后出现黄色固体
试管中液体变浑浊
结论
催化活性:Fe3+>Cu2+
氧化性:Br2>I2
Ksp:AgCl>AgBr>AgI
非金属性:C>Si
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
以稀硫酸为电解质溶液,利用太阳能将CO2转化为低碳烯烃,工作原理如图。下列说法正确的是( )
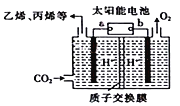
A. a电极为太阳能电池的正极
B. 太阳能电池的原理与原电池的原理相同
C. 产生丙烯的电极反应式为:3CO2+18H++18e—===6H2O+CH3CH=CH2
D. 装置中每转移2mole—,理论上有2molH+通过质子交换膜从左向右扩散
难度: 简单查看答案及解析
-
将含有0.4molCuSO4和0.4molNaCl的水溶液1L,用惰性电极电解一段时间后,某一电极增重19.2g时,则在另一电极上析出的气体在标准状况下的体积是( )
A. 5.6L B. 6.72L C. 13.44L D. 11.2L
难度: 中等查看答案及解析