-
为倡导“节能减排”和“低碳经济”,目前工业上有一种方法是用CO2来生产燃料乙醇: 2CO2(g)+6H2(g)  CH3CH2OH(g)+3H2O(g) ΔH<0。在一定条件下,温度在450 K,在20 L密闭容器中按物质的量比为1∶3充入CO2和H2.
CH3CH2OH(g)+3H2O(g) ΔH<0。在一定条件下,温度在450 K,在20 L密闭容器中按物质的量比为1∶3充入CO2和H2.
(1)n(H2)随时间变化如表所示:
| t/min | 0 | 1 | 3 | 5 |
| n(H2)/mol | 8 | 6 | 5 | 5 |
在450 ℃、0~1 min,v(CO2)=________;此温度下该反应的化学平衡常数为 ________(结果保留三位有效数字)。
(2) 在5 MPa下测得平衡体系中各物质的体积分数随温度的变化曲线如图所示:
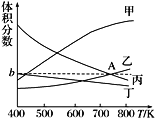
曲线乙表示的是 ________(填物质的化学式)的体积分数,图像中A点对应的体积分数b=________%(结果保留三位有效数字)。
(3)下列措施中能使化学平衡向正反应方向移动的是 ________。
A.升高温度 B.将CH3CH2OH(g)及时液化抽出
C.选择高效催化剂 D.再充入l mol CO2和3 mol H2
(4)25 ℃、1.01×105Pa时,9.2 g液态乙醇完全燃烧,当恢复到原状态时,放出273.4 kJ的热量,写出表示乙醇燃烧的热化学方程式: _________________。
(5)以石墨为电极,氢氧化钠、乙醇、水、氧气为原料的燃料电池,写出发生还原反应的电极反应式: _______________。
-
为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量及有效地开发利用CO2,科学家正在研究如何将CO2转化为可利用的资源.目前工业上有一种方法是用CO2来生产燃料甲醇.一定条件下发生反应:
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),
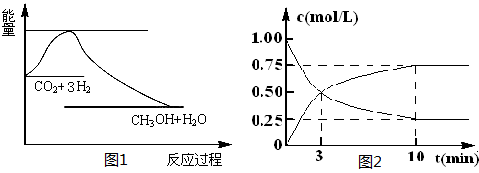
(1)图1表示该反应过程中能量变化,则该反应为________反应(填“吸热”或“放热”),判断依据是________;
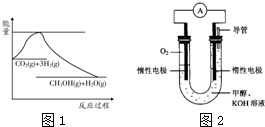
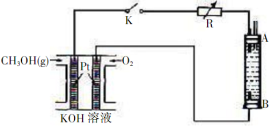
(2)某实验小组依据甲醇燃烧的反应原理,设计如图2所示的电池装置.
①该电池正极的电极反应式为:________;
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为:________;
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:________;
(4)为了消除污染,在一定条件下,向含有甲醇的废水中加入一定量的稀硝酸,会有N2等物质生成.若参加反应的氧化剂和还原剂的物质的量之比为6:5,写出该反应的化学方程式________;在此反应过程中若消耗32g 甲醇,将转移________mol 电子.
-
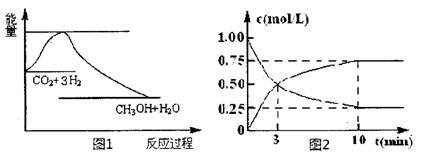
(14分)实现“节能减排”和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
(1)关于该反应的下列说法中,正确的是____________(填字母)。
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和 4molH2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
①从反应开始到平衡,CH3OH的平均反应速率v(CH3OH)=___________;H2的转化率w(H2)=_________________。
②该反应的平衡常数表达式K=____________。
③下列措施中能使化学平衡向正反应方向移动的是___________(填字母)。
A.升高温度 B.将CH3OH(g)及时液化抽出
C.选择高效催化剂 D.再充入1molCO2和4 molH2
(3)25℃,1.01×10 5Pa时,16g液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,写出该反应的热化学方程式:__________________________。
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此电池的负极应加入和通入的物质有_____________;其正极的电极反应式是:_____________________。
-
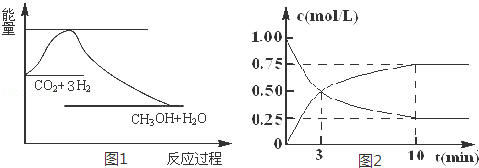
实现“节能减排”和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源.目前工业上有一种方法是用CO2来生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),图1表示该反应过程中能量变化:
(1)关于该反应的下列说法中,正确的是 (填字母).
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入l mol CO2和4mol H2,一定条件下发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),测得CO2和CH3O(g)的浓度随时间变化如图2所示.
①从反应开始到平衡,CO2的平均反应速率v(CO2)= mol/(L.min)
②该反应的平衡常数表达式K=
③下列措施中能使化学平衡向正反应方向移动的是 (填字母)
A.升高温度 B.将CH3OH(g)及时液化抽出 C.选择高效催化剂
(3)25℃,1.01105Pa时,16g 液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,写出该反应的热化学方程式: .
-
实现 “节能减排” 和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
(1)关于该反应的下列说法中,正确的是________(填字母)。
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入l mol CO2和4mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
①从反应开始到平衡,CH3OH的平均反应速率v(CH3OH) =________ ;H2的转化率w(H2) =。
②该反应的平衡常数表达式K=________。
③下列措施中能使化学平衡向正反应方向移动的是 (填字母)。
A.升高温度
B.将CH3OH(g)及时液化抽出
C.选择高效催化剂
D.再充入l molCO2和4 molH2
(3)25℃,1.01×105Pa时,16g 液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,写出该反应的热化学方程式:________。
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此电池的负极应加入和通入的物质有________;其正极的电极反应式是:________。
-
实现“节能减排”和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),下图表示该反应过程中能量(单位为kJ·mol-1)的变化如图,关于该反应的下列说法中,正确的是
CH3OH(g)+H2O(g),下图表示该反应过程中能量(单位为kJ·mol-1)的变化如图,关于该反应的下列说法中,正确的是
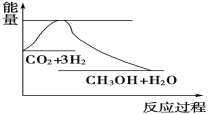
A. ΔH>0,ΔS>0 B. ΔH>0,ΔS<0 C. ΔH<0,ΔS>0 D. ΔH<0,ΔS<0
-
实现“节能减排”和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),下图表示该反应过程中能量(单位为kJ·mol-1)的变化如图,关于该反应的下列说法中,正确的是
CH3OH(g)+H2O(g),下图表示该反应过程中能量(单位为kJ·mol-1)的变化如图,关于该反应的下列说法中,正确的是
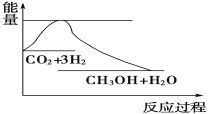
A. ΔH>0,ΔS>0 B. ΔH>0,ΔS<0 C. ΔH<0,ΔS>0 D. ΔH<0,ΔS<0
-
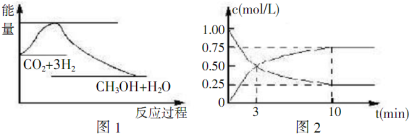
实现节能减排和低碳经济的一项重要课题就是研究如何将CO2转化为可利用的资源,目前工业上有一种方法是用CO2来生产燃料甲醇,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ/mol ) 的变化,据此回答下列有关问题:
CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ/mol ) 的变化,据此回答下列有关问题:
(1)25℃时,1.01×105Pa,16g液态甲醇完全燃烧,当恢复到原状态时放出363.3kJ的热量,写出该反应的热化学方程式______________。
(2)为探究反应原理,现进行如下实验:某温度下,在体积为lL的密闭容器中充入lmolCO2和4molH2,一定条件下发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CO2的浓度随时间变化如上图2所示.
CH3OH(g)+H2O(g),测得CO2的浓度随时间变化如上图2所示.
①从反应开始到平衡,CH3OH的平均反应速率v(CH3OH)=______________;H2的转化率为______________.
②若向该容器中加入 amolCO2、bmolH2、cmolCH3OH(g)和dmolH2O(g),且a、b、c、d均大于0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同,试比较反应放出的能量:①______________②(填“大于”“小于” 或“等于”)
③下列措施中能使H2的转化率提高的是______________(填字母)。
A.升高温度 B.将CH3OH(g)及时液化抽出
C.选择高效催化剂 D.相同条件下 再充入lmolCO2和4molH2
(3)甲醇是一种可再生能源具有广泛的开发和应用前景。某实验小组用一种以甲醇为原料的燃料电池作为电源,设计了一种电解法制取Fe(OH)2的实验装置如(下图所示),通电后溶液中产生大量白色沉淀且较长时间不变色。
①该燃料电池的负极反应为______________。
②下列说法中正确的是______________(填序号)
A.电源中的负极附近 pH升高
B.电极B的发生氧化反应
C.A、B两端都必须用铁作电极
D.阴极发生的反应是2H++2e-=H2↑
E.电解的电解质溶液可以是CuSO4溶液
③若电池中甲醇的通入量为8g,且反应完全,则理论上最多能产生沉淀______________g。
-
目前工业上有一种用CO2来生产燃料甲醇的方法,可以将CO2变废为宝。
(1)已知在常温常压下:
①2CH3OH(l)+3O2(g)= 2CO2(g)+4H2O(g) △H= _1275.6 kJ·mol-1
②2CO(g)+ O2(g)= 2CO2(g) △H= _556.0 kJ·mol-1
③H2O(l) = H2O(g) △H=+ 44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式________。
(2)某同学利用甲醇燃料电池为电源,设计了一种电解法制取Fe(OH)2的实验装置(如图),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。则电源中a极为________极(填“正”或“负”),其电极反应式为 。装置上端A极电极材料是________(填化学式),B电极上的电极反应式为________。

(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:CO(g) +H2O(g) CO2(g) + H2(g),得到如下三组数据:
CO2(g) + H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min |
| H2O | CO | CO2 |
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
①该反应的正反应为________(填“吸”或“放”)热反应。
②实验1中,以v(H2)表示的平均反应速率为________。
③900℃时,按CO(g)、H2O(g)、CO2(g) 和 H2(g)的物质的量分别是0.8mol、1.0mol、0.6 mol和0.8 mol分别加入该容器,则此时反应的v(正)________v(逆)(填“>”“<”或“=”中之一)。
④实验3跟实验2相比,改变的条件可能是________。
-
乙醇是重要的化工原料和液体燃料,可以利用下列反
应制取乙醇:
2CO2(g) + 6H2(g) CH3CH2OH(g) + 3H2O(g)
(1)写出该反应的平衡常数表达式:K=_________________________。
(2)请说明以CO2为原料合成乙醇的优点是________________________________(只要求写出一条)。
(3)在一定压强下,测得该反应的实验数据如下表:
| 
| 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
① 该反应是___________反应(填“吸热”或“放热”)。
② 一定条件下,若提高氢碳比[n(H2)/n(CO2)],则CO2的转化率______________;平衡常数K______________。(填“增大”、“减小”、或“不变”)
 (4)在右图的坐标系中作图说明压强变化对该反应化学平衡的
(4)在右图的坐标系中作图说明压强变化对该反应化学平衡的
影响,并对图中横坐标、纵坐标的含义作必要的标注。
(5)一种乙醇燃料电池中发生的化学反应为:在酸性溶液中乙醇
与氧作用生成水和二氧化碳。该电池的负极反应式为:
___________________________________________________。
(6)25℃、101 kPa下,H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是285.8 kJ · mol-1、1411.0 kJ · mol-1和1366.8 kJ · mol-1,请写出由C2H4(g)和H2O(l)反应生成C2H5OH(l)的热化学方程式_______________________________________________________________。
CH3CH2OH(g)+3H2O(g) ΔH<0。在一定条件下,温度在450 K,在20 L密闭容器中按物质的量比为1∶3充入CO2和H2.









