-
目前工业上有一种用CO2来生产燃料甲醇的方法,可以将CO2变废为宝。
(1)已知在常温常压下:
①2CH3OH(l)+3O2(g)= 2CO2(g)+4H2O(g) △H= _1275.6 kJ·mol-1
②2CO(g)+ O2(g)= 2CO2(g) △H= _556.0 kJ·mol-1
③H2O(l) = H2O(g) △H=+ 44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式________。
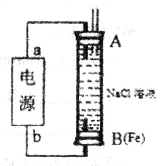
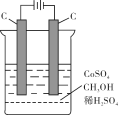
(2)某同学利用甲醇燃料电池为电源,设计了一种电解法制取Fe(OH)2的实验装置(如图),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。则电源中a极为________极(填“正”或“负”),其电极反应式为 。装置上端A极电极材料是________(填化学式),B电极上的电极反应式为________。

(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:CO(g) +H2O(g) CO2(g) + H2(g),得到如下三组数据:
CO2(g) + H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min |
| H2O | CO | CO2 |
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
①该反应的正反应为________(填“吸”或“放”)热反应。
②实验1中,以v(H2)表示的平均反应速率为________。
③900℃时,按CO(g)、H2O(g)、CO2(g) 和 H2(g)的物质的量分别是0.8mol、1.0mol、0.6 mol和0.8 mol分别加入该容器,则此时反应的v(正)________v(逆)(填“>”“<”或“=”中之一)。
④实验3跟实验2相比,改变的条件可能是________。
-
(10分)目前工业上有一种用CO2来生产燃料甲醇的方法,可以将CO2变废为宝。
(1)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=_1275.6kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H=_556.0kJ•mol-1
③H2O(g)=H2O(l)△H=-44.0kJ•mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:___________________。
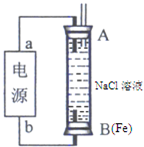
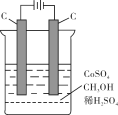
(2)某同学利用甲醇(酸性)燃料电池为电源,设计了一种电解法制取Fe(OH)2的实验装置(如下图)。通电后,下图竖直装置下端B极上有大量气泡产生,溶液中产生大量的Fe(OH)2白色沉淀,且较长时间不变色。则电源中b极为______极(填“正”或“负”),其电极反应式为__________________,装置上端A极电极材料是: ____(填化学式),B电极上的电极反应式为____________。
(3)利用电解法在铁制品上镀铜可以防止铁被腐蚀,以下说法正确的是_____。
a.电镀时,通常用铜做阳极,可溶性铜盐作电解质溶液
b. 电镀过程中,维持电流恒定,温度升高,电解反应速率加快
c.电镀过程中,电能全部转化为化学能
d.电镀过程中,铜离子向阴极移动,发生还原反应
-
目前工业上有一种用CO2来生产燃料甲醇的方法,可以将CO2变废为宝.
(1)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=_1275.6kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H=_556.0kJ•mol-1
③H2O(l)=H2O(g)△H=+44.0kJ•mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式______
(2)某同学利用甲醇燃料电池为电源,设计了一种电解法制取Fe(OH)2的实验装置(如图),通电后,溶液中产生大量的白色沉淀,且较长时间不变色.则电源中a极为______极(填“正”或“负”),其电极反应式为______.装置上端A极电极材料是______(填化学式),B电极上的电极反应式为______.
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)⇌CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min |
| H2O | CO | CO2 |
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
①该反应的正反应为______(填“吸”或“放”)热反应.
②实验1中,以v(H2)表示的平均反应速率为______.
③900℃时,按CO(g)、H2O(g)、CO2(g) 和 H2(g)的物质的量分别是0.8mol、1.0mol、0.6mol和0.8mol分别加入该容器,则此时反应的v(正)______v(逆)(填“>”“<”或“=”中之一).
④实验3跟实验2相比,改变的条件可能是______.
-
工业上“固定”和利用CO2能有效地减轻“温室效应”.
(1)目前工业上利用CO2来生产燃料甲醇,可将CO2变废为宝.已知常温常压下:
①CH3OH(l)+O2(g)═CO(g)+2H2O(g)△H=-354.8kJ/mol
②2CO(g)+O2(g)═2CO2(g)△H=-566kJ/mol
则反应2CO2(g)+4H2O(g)═2CH3OH(l)+3O2(g)△H=______kJ•mol-1
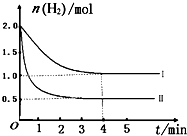
(2)T℃时,已知反应:CO2(g)+H2(g)⇌CO(g)+H2O(g)△H<0.在T℃下,将2mol CO2和2mol H2充入1L的密闭容器中,测得H2的物质的量随时间的变化情况如图中曲线I所示.
①按曲线I计算反应从0到4min时,υ(H2)=______.
②在T℃时,若仅改变某一外界条件时,测得H2的物质的量随时间的变化情况如图中曲线Ⅱ所示,则改变的外界条件为______.计算该反应按曲线II进行,达到平衡时,容器中c(CO2)=______.
(3)已知25℃时,乙酸和碳酸的电离平衡常数如下表:
| 物质的化学式 | CH3COOH | H2CO3 |
| 电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 | K2=5.6×10-11 |
①用饱和氨水吸收CO2可得到NH4HCO3溶液.若已知CH3COONH4溶液pH=7,则 NH4HCO3溶液显______(填“酸性”、“碱性”或“中性”).
②在25℃时,在乙酸溶液中加入一定量的NaHCO3,保持温度不变,所得混合液的pH=6,那么混合液中 =______.
=______.
③向0.1mol•L -1CH3COOH溶液中加入少量CH3COONa晶体,保持温度不变,下列有关说法正确的是______(填代号).
a.溶液的pH增大 b.CH3COOH的电离程度增大
c.溶液的导电能力减弱 d.溶液中c(OH-)•c(H+)不变.
-
甲醇可作为燃料电池的原料。工业上利用CO2和H2在一定条件下反应合成甲醇。
(1)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH=-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH=-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
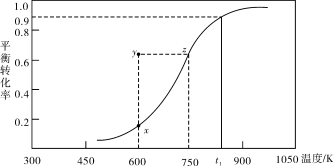
(2)甲醇脱氢可制取甲醛CH3OH(g) HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题:
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题:
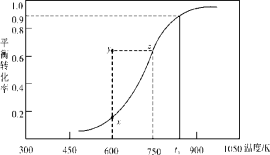
①600K时,Y点甲醇的υ(逆) (正)(填“>”或“<”)
②从Y点到X点可采取的措施是____________________________。
③有同学计算得到在t1K时,该反应的平衡常数为8.1mol·L-1。你认为正确吗?请说明理由 。
(3)纳米级Cu2O由于具有优良的催化性能而受到关注。在相同的密闭容器中,使用不同方法制得的Cu2O(Ⅰ)和(Ⅱ)分别进行催化CH3OH的脱氢实验:CH3OH(g) HCHO(g)+H2(g)
HCHO(g)+H2(g)
CH3OH的浓度(mol·L-1)随时间t (min)变化如下表:
| 序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
可以判断:实验①的前20 min的平均反应速率 ν(H2)= ;实验温度T1 T2(填“>”、“<”);催化剂的催化效率:实验① 实验②(填“>”、“<”)。
(4)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+)。现用如下图所示装置模拟上述过程, 除去甲醇的离子方程式为 。
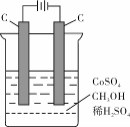
-
甲醇可作为燃料电池的原料。工业上利用CO2和H2在一定条件下反应合成甲醇。
(1)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH=-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH=-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
(2)甲醇脱氢可制取甲醛CH3OH(g) HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题:
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题:
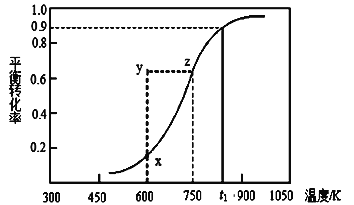
①600K时,Y点甲醇的υ(逆) (正)(填“>”或“<”)
②从Y点到X点可采取的措施是____________________________。
③有同学计算得到在t1K时,该反应的平衡常数为8.1mol·L-1。你认为正确吗?请说明理由 。
(3)纳米级Cu2O由于具有优良的催化性能而受到关注。在相同的密闭容器中,使用不同方法制得的Cu2O(Ⅰ)和(Ⅱ)分别进行催化CH3OH的脱氢实验:CH3OH(g) HCHO(g)+H2(g)
HCHO(g)+H2(g)
CH3OH的浓度(mol·L-1)随时间t (min)变化如下表:
| 序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
可以判断:实验①的前20 min的平均反应速率 ν(H2)= ;实验温度T1 T2(填“>”、“<”);催化剂的催化效率:实验① 实验②(填“>”、“<”)。
(4)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+)。现用如下图所示装置模拟上述过程, 除去甲醇的离子方程式为 。
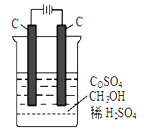
-
(15分)甲醇可作为燃料电池的原料。工业上利用CO2和H2在一定条件下反应合成甲醇。
(1)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH=-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH=-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
(2)甲醇脱氢可制取甲醛CH3OH(g) HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题:
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题:
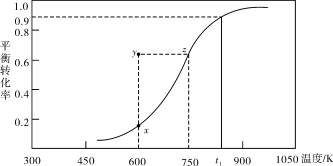
①600K时,Y点甲醇的υ(逆) (正)(填“>”或“<”)
②从Y点到X点可采取的措施是______________________________________。
③有同学计算得到在t1K时,该反应的平衡常数为8.1mol·L-1。你认为正确吗?请说明理由 。
(3)纳米级Cu2O由于具有优良的催化性能而受到关注。在相同的密闭容器中,使用不同方法制得的Cu2O(Ⅰ)和(Ⅱ)分别进行催化CH3OH的脱氢实验:CH3OH(g) HCHO(g)+H2(g)。CH3OH的浓度(mol·L-1)随时间t (min)变化如下表:
HCHO(g)+H2(g)。CH3OH的浓度(mol·L-1)随时间t (min)变化如下表:
| 序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
可以判断:实验①的前20 min的平均反应速率 ν(H2)= ;
实验温度T1 T2(填“>”、“<”);催化剂的催化效率:实验① 实验②(填“>”、“<”)。
(4)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+)。现用如下图所示装置模拟上述过程,
则Co2+在阳极的电极反应式为 ;除去甲醇的离子方程为 。
-
(15分)甲醇可作为燃料电池的原料。工业上利用CO2和H2在一定条件下反应合成甲醇。
(1)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH=-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH=-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
(2)甲醇脱氢可制取甲醛CH3OH(g) HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题:
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题:
①600K时,Y点甲醇的υ(逆) (正)(填“>”或“<”)
②从Y点到X点可采取的措施是______________________________________。
③有同学计算得到在t1K时,该反应的平衡常数为8.1mol·L-1。你认为正确吗?请说明理由 。
(3)纳米级Cu2O由于具有优良的催化性能而受到关注。在相同的密闭容器中,使用不同方法制得的Cu2O(Ⅰ)和(Ⅱ)分别进行催化CH3OH的脱氢实验:CH3OH(g) HCHO(g)+H2(g)
HCHO(g)+H2(g)
CH3OH的浓度(mol·L-1)随时间t (min)变化如下表:
| 序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
可以判断:实验①的前20 min的平均反应速率 ν(H2)= ;实验温度
T1 T2(填“>”、“<”);催化剂的催化效率:实验① 实验②(填“>”、“<”)。
(4)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+)。现用如下图所示装置模拟上述过程,则Co2+在阳极的电极反应式为 ;除去甲醇的离子方程式为 。
-
甲醇可作为燃料电池的原料。工业上利用CO2和H2在一定条件下反应合成甲醇。
(1)已知在常温常压下:
① 2CH3OH(l)+3O2(g) ===2CO2(g)+4H2O(g) ΔH=-1275.6 kJ/mol
② 2CO (g)+ O2(g) === 2CO2(g) ΔH=-566.0 kJ/mol
③ H2O(g) ===H2O(l) ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:______________
(2)甲醇脱氢可制取甲醛CH3OH(g) HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题:
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题:
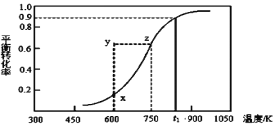
①600K时,Y点甲醇的υ(逆)_____υ(正)(填“>”或“<”)
②若改变条件使之从Y点到X点,则改变条件可以是___________。
(3)纳米级Cu2O由于具有优良的催化性能而受到关注。在相同的密闭容器中,使用不同方法制得的Cu2O(I)和(II)分别进行催化CH3OH的脱氢实验:CH3OH(g) HCHO(g)+H2(g),CH3OH的浓度(mol·L-1)随时间t (min)变化如下表:
HCHO(g)+H2(g),CH3OH的浓度(mol·L-1)随时间t (min)变化如下表:
| 序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
可以判断:实验①的前20 min的平均反应速率 ν(H2)=________;实验温度T1_____T2(填“>”、“<”);催化剂的催化效率:实验①________实验②(填“>”、“<”)。
(4)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+)。现用如下图所示装置模拟上述过程, 除去甲醇的离子方程式为____________
-
CO、CO2是火力发电厂释放出的主要尾气,为减少对环境造成的影响,发电厂试图采用以下方法将其资源化利用,重新获得燃料或重要工业产品。
(1)用CO2来生产燃料甲醇的方法,可以将CO2变废为宝。
已知在常温常压下,甲醇、CO的燃烧热分别是726.5kJ·mol-1、110.5 kJ·mol-1。写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:_____;
(2)CO与Cl2在催化剂的作用下合成光气(COCl2)。某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g) +Cl2(g)  COCl2(g) ΔH = a kJ/mol反应过程中测定的部分数据如下表:
COCl2(g) ΔH = a kJ/mol反应过程中测定的部分数据如下表:
| t/min | n(CO)/mol | n(Cl2)/mol |
| 0 | 1.20 | 0.60 |
| 1 | 0.90 | |
| 2 | 0.80 | |
| 4 | | 0.20 |
①反应0~2min末的平均速率v(COCl2)=__________mol/(L·min)。
②在2min~4min间,v(Cl2)正______v(Cl2)逆 (填“>”、“=”或“<”), 该温度下K =______。
③已知X、L可分别代表温度或压强,下图表示L一定时,CO的 转化率随X的变化关系。X代表的物理量是__________;a_________0 (填“>”,“=”,“<”)。

(3)在催化剂作用下NO和CO转化为无毒气体:
2CO(g)+2NO(g) 2CO2 (g)+N2 (g)
2CO2 (g)+N2 (g)
ΔH=-748 kJ·mol-1
①一定条件下,单位时间内不同温度下测定的氮氧化物转化率如图1所示。温度高于710K时,随温度的升高氮氧化物转化率降低的原因可能是____________________。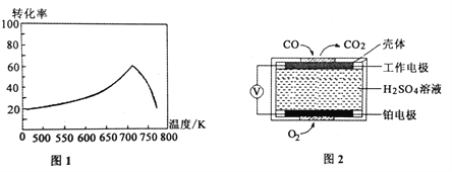
②已知:测定空气中NO和CO含量常用的方法有两种,方法1:电化学气敏传感器法。其中CO传感器的工作原理如图2所示,则工作电极的反应式为______________________;方法2:氧化还原滴定法。用H2O2溶液吸收尾气,将氮氧化物转化为强酸,用酸碱中和滴定法测定强酸浓度。写出NO与H2O2溶液反应的离子方程式_______________。
(4)用CO和H2可以制备甲醇,反应为CO(g)+2H2(g)  CH3OH(g),以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)若电解质溶液中KOH的物质的量为0.8mol,当有0.5mol甲醇参与反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是_______________。
CH3OH(g),以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)若电解质溶液中KOH的物质的量为0.8mol,当有0.5mol甲醇参与反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是_______________。

CO2(g) + H2(g),得到如下三组数据:














